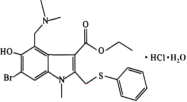
��Ŀ����
����Ŀ����KMnO4������Һ��������ͭ��Cu2S���Ͷ���������FeS2���Ļ����ʱ�������ķ�Ӧ����![]() +Cu2S+H+��Cu2++
+Cu2S+H+��Cu2++![]() +Mn2++H2O(δ��ƽ)�ͷ�Ӧ����
+Mn2++H2O(δ��ƽ)�ͷ�Ӧ����![]() +FeS2+H+��Fe3++
+FeS2+H+��Fe3++![]() +Mn2++H2O(δ��ƽ)������˵����ȷ���ǣ� ��
+Mn2++H2O(δ��ƽ)������˵����ȷ���ǣ� ��
A.��Ӧ����Cu2S�������������ǻ�ԭ��
B.��Ӧ����ÿ����1mol![]() ��ת�Ƶ��ӵ����ʵ���Ϊ10mol
��ת�Ƶ��ӵ����ʵ���Ϊ10mol
C.��Ӧ�����������뻹ԭ�������ʵ���֮��Ϊ1��3
D.����Ӧ���ͷ�Ӧ�������ĵ�KMnO4�����ʵ�����ͬ����Ӧ���ͷ�Ӧ�������ĵĻ�ԭ�������ʵ���֮��Ϊ3��2
���𰸡�BD
��������
![]() ��MnԪ��Ϊ+7�ۣ�Cu2S��Cu��SԪ�طֱ�Ϊ+1��-2�ۣ�FeS2��Fe��SԪ�طֱ�Ϊ+2��-1�ۡ�
��MnԪ��Ϊ+7�ۣ�Cu2S��Cu��SԪ�طֱ�Ϊ+1��-2�ۣ�FeS2��Fe��SԪ�طֱ�Ϊ+2��-1�ۡ�
A����Ӧ����Cu2S��Cu��S�Ļ��ϼ۶����ߣ�����������Ӧ����Cu2SΪ��ԭ����MnԪ�صĻ��ϼ۽��ͣ�������ԭ��Ӧ��![]() Ϊ��������A����
��������A����
B����Ӧ����ÿ����1mol![]() ���μӷ�Ӧ��Cu2SΪ1mol��Cu2S���ϼ۹�����2(2-1)+(6+2)=10����Ӧת�Ƶ��ӵ����ʵ���Ϊ10mol��B��ȷ��
���μӷ�Ӧ��Cu2SΪ1mol��Cu2S���ϼ۹�����2(2-1)+(6+2)=10����Ӧת�Ƶ��ӵ����ʵ���Ϊ10mol��B��ȷ��
C����Ӧ����������![]() ���ϼ۽���(7-2)=5����ԭ��FeS2���ϼ۹�����1+2(6+1)=15�����ݵ�ʧ������ȣ��������뻹ԭ�������ʵ���֮��Ϊ15��5=3��1��C����
���ϼ۽���(7-2)=5����ԭ��FeS2���ϼ۹�����1+2(6+1)=15�����ݵ�ʧ������ȣ��������뻹ԭ�������ʵ���֮��Ϊ15��5=3��1��C����
D������Ӧ���ͷ�Ӧ�������ĵ�KMnO4�����ʵ�����ͬ�� 1molKMnO4�õ�5mol���ӣ�Cu2S���ϼ۹�����2(2-1)+(6+2)=10��Ӧ����0.5molCu2S��FeS2���ϼ۹�����1+2(6+1)=15��Ӧ����![]() mol=
mol=![]() mol FeS2����Ӧ���ͷ�Ӧ�������ĵĻ�ԭ�������ʵ���֮��Ϊ0.5mol��
mol FeS2����Ӧ���ͷ�Ӧ�������ĵĻ�ԭ�������ʵ���֮��Ϊ0.5mol��![]() mol=3��2��D��ȷ��
mol=3��2��D��ȷ��
��ѡBD��