题目内容
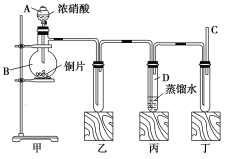
【题目】已知:某些强酸盐的水溶液呈中性,如NaCl溶液,某些弱酸盐的水溶液呈碱性,如Na2CO3溶液。请根据如下图所示转化关系回答有关问题。A和B均为焰色反应呈黄色的水溶液,A呈中性,B呈碱性并具有强氧化性。

(1)写出C的化学式:________。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式: ___________________,_____________________。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:____________。
(4)检验K溶液中阳离子的简易方法是__________。
【答案】AgI 2I-+ClO-+H2O=I2+Cl-+2OH- I2+5ClO-+2OH-=2IO3-+5Cl-+H2O 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ 取少量K溶液于试管中,滴加少量的KSCN溶液,溶液变红
【解析】
A、B的焰色反应均为黄色,则A、B均含有Na元素;A和AgNO3溶液生成不溶于稀HNO3的黄色沉淀C为AgI,则说明A为NaI溶液;B和浓盐酸反应生成的黄绿色气体F为Cl2,且B呈碱性,则B为NaClO溶液,K为FeCl3溶液,H为NaCl和NaClO的混合溶液;将B逐滴滴入A中,NaClO将NaI氧化为I2(D),再继续加入B,NaClO将I2氧化,根据题(2)可以推测E为NaIO3溶液。
(1)根据分析,C为AgI;
(2)A为NaI溶液,D为I2,E为NaIO3溶液,A→D的离子方程式为:2I-+ClO-+H2O=I2+Cl-+2OH-,D→E的离子方程式为:I2+5ClO-+2OH-=2IO3-+5Cl-+H2O;
(3)K溶液为FeCl3溶液,向此溶液中通入SO2的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(4)K溶液中阳离子为Fe3+,检验该阳离子的方法为:取少量K溶液于试管中,滴加少量的KSCN溶液,若溶液变红,说明该溶液中含有Fe3+。

 阅读快车系列答案
阅读快车系列答案【题目】M溶液受热会发生分解反应。体积均为2L的4组溶液(忽略反应前后体积的变化),M的物质的量随时间的变化如下表,则下列说法不正确的是
0min | 10min | 20min | 30min | 40min | 50min | 60min | ||
① | 10℃ | 1.1 | 0.90 | 0.80 | 0.73 | 0.68 | 0.65 | 0.65 |
② | 10℃ | a | 0.70 | 0.65 | 0.65 | 0.65 | 0.65 | 0.65 |
③ | 25℃ | 1.0 | 0.70 | 0.50 | 0.35 | 0.25 | 0.20 | 0.20 |
④ | 30℃ | 2.0 | 1.4 | 0.90 | 0.50 | 0.20 | 0.13 | 0.13 |
A.在10-20min内,实验①中M的平均分解速率为0.005mol/(L·min)
B.a>1.1,且说明浓度越大反应速率越快
C.对比实验①和④,不能说明M的平均反应速率随温度升高而增大
D.不考虑其它影响因素,仅由③可知,反应物浓度越大反应速率越快