题目内容
17.Ⅰ. 请回答:(1)H2O2的电子式
 .
.(2)煤燃烧不能用CO2灭火,用化学方程式表示其理由C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO.
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式AgCl(s)+Br-═AgBr(s)+Cl-.
(4)完成以下氧化还原反应的离子方程式:2MnO${\;}_{4}^{-}$+( )C2O${\;}_{4}^{2-}$+16H+=2Mn2++10CO2↑+8H2O.
Ⅱ. 化合物甲和NaAlH4都是重要的还原剂.一定条件下金属钠和H2反应生成甲.甲与水反应可产生H2,甲与AlCl3反应可得到NaAlH4.将4.80g甲加热至完全分解,得到金属钠和2.24L(已折算成标准状况) 的H2.
请推测并回答:
(1)甲的化学式NaH.
(2)甲与AlCl3反应得到NaAlH4的化学方程式4NaH+AlCl3=NaAlH4+3NaCl.
(3)NaAlH4与水发生氧化还原反应的化学方程式NaAlH4+2H2O=NaAlO2+4H2↑.
(4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3) 脱锈过程发生的化学方程式3NaH+Fe2O3=2Fe+3NaOH.
(5)某同学认为:用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫酸干燥,再与金属钠反应,得到固体物质即为纯净的甲;取该固体物质与水反应,若能产生H2,即可证明得到的甲一定是纯净的.
判断该同学设想的制备和验纯方法的合理性并说明理由制备过程不合理,因为盐酸易挥发,氢气中混有HCl,导致产物中有NaCl;验纯方法不合理,如果有Na残留,Na与水反应也产生氢气,且没有考虑混入的NaCl.
分析 I.(1)双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
(2)高温下,C与二氧化碳反应生成易燃的CO;
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,说明生成AgBr;
(4)反应中Mn元素化合价由+7价降低为+2价,共降低5价,C元素化合价由+3价升高为+4价,共升高2价,化合价升降最小公倍数为10,可以确定MnO4-的系数为2、C2O42-的系数为5,由原子守恒可知Mn2+的系数为2、CO2的系数为10,由电荷守恒可知,反应物中缺项为H+,由元素守恒可知生成物中缺项为H2O.
II.(1)钠元素在化合物中只能形成+1价,据此结合生成氢气的物质的量判断其化学式即可;
(2)NaH与AlCl3反应可得到NaAlH4,此反应无化合价的变化,据此书写;
(3)NaAlH4与水反应生成氢气,应是水中的H元素与NaH中的H元素之间得失电子,据此书写即可;
(4)由题意可知NaH常做还原剂那么铁锈为氧化剂,反应生成铁单质,据此书写;
(5)制备过程中未指明吸收杂质气体HCl,据此解答;氢气与金属钠反应未指明钠的用量,钠可能过量,过量的钠也可以与水反应生成氢气.
解答 解:I.(1)双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为 ,故答案为:
,故答案为: ;
;
(2)高温下,C与二氧化碳反应生成易燃的CO,反应为C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO,故答案为:C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO;
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,说明生成AgBr,反应离子方程式为AgCl(s)+Br-═AgBr(s)+Cl-,
故答案为:AgCl(s)+Br-═AgBr(s)+Cl-;
(4)反应中Mn元素化合价由+7价降低为+2价,共降低5价,C元素化合价由+3价升高为+4价,共升高2价,化合价升降最小公倍数为10,可以确定MnO4-的系数为2、C2O42-的系数为5,由原子守恒可知Mn2+的系数为2、CO2的系数为10,由电荷守恒可知,反应物中缺项为H+,由元素守恒可知生成物中缺项为H2O,配平后离子方程式为:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O,
故答案为:2;5;16H+;2;10;8H2O;
II.(1)Na在化合价中呈现+1价,故该物质的化学式可能为NaH,又甲与AlCl3反应可得到NaAlH4,Al的化合价为+3,故H元素的化合价为-1,4.80g甲加热至完全分解,得到金属钠和2.24L,即0.1mol氢气,
化学反应方程式为:2NaH$\frac{\underline{\;加热\;}}{\;}$2Na+H2↑
48g 22.4L
4.8g 2.24L
故此化合物为NaH,
故答案为:NaH;
(2)NaH与AlCl3反应可得到NaAlH4,此反应无化合价的变化,根据原子守恒推测另一种生成物,化学反应方程式为:4NaH+AlCl3=NaAlH4+3NaCl,
故答案为:4NaH+AlCl3=NaAlH4+3NaCl;
(3)NaAlH4与水反应生成氢气,即NaH中H化合价升高,水中H元素化合价降低,化学反应方程式为:NaAlH4+2H2O=NaAlO2+4H2↑,
故答案为:NaAlH4+2H2O=NaAlO2+4H2↑;
(4)NaH常做还原剂(H化合价升高为+1价),铁锈在此为氧化剂(Fe化合价降低为0价),反应生成铁单质,化学反应方程式为:3NaH+Fe2O3=2Fe+3NaOH,
故答案为:3NaH+Fe2O3=2Fe+3NaOH;
(5)稀盐酸具有挥发性,且可以利用浓硫酸干燥,故制取的氢气中可能混有杂质气体HCl,那么制取的甲中就混有NaCl,验证过程中未排除金属钠的干扰,过量的金属能也可以与水反应生成氢气.
故答案为:制备过程不合理,因为盐酸易挥发,氢气中混有HCl,导致产物中有NaCl;验纯方法不合理,如果有Na残留,Na与水反应也产生氢气,且没有考虑混入的NaCl.
点评 本题考查知识点较多,涉及电子式、沉淀的转化、氧化还原反应方程式的配平、元素化合物的性质等,属于拼合型题目,需要学生具备扎实的基础,难度中等.

| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ•mol-1) | 414.4 | 615.3 | 347.4 | 435.3 |
| A. | 125.6kJ•mol-1 | B. | -125.6kJ•mol-1 | C. | 46.1kJ•mol-1 | D. | -46.1kJ•mol-1 |
| A. | 金刚砂 | B. | 石英 | C. | 水玻璃 | D. | 粘土 |
| A. | O2 | B. | Cl2 | C. | CO2 | D. | CH4 |
| A. | 冰毒、甘油 | B. | 尼古丁、维生素 | C. | 味精、可卡因 | D. | 吗啡、大麻 |
| A. | 2Fe+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3 | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | CaO+CO2═CaCO3 | D. | 2H2O+2Na═2NaOH+H2↑ |
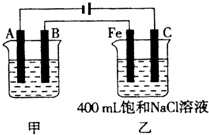 如图为相互串联的甲、乙两电解池.试回答:
如图为相互串联的甲、乙两电解池.试回答: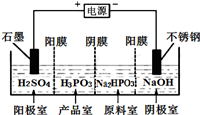 (1)亚磷酸(H3PO3)是二元酸,与足量NaOH溶液反应,生成Na2HPO3,电解Na2HPO3溶液可得到亚磷酸,装置示意图如下:
(1)亚磷酸(H3PO3)是二元酸,与足量NaOH溶液反应,生成Na2HPO3,电解Na2HPO3溶液可得到亚磷酸,装置示意图如下: