题目内容
6.取一定量的Na2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到a g白色沉淀,用过量稀硝酸处理后沉淀量减小到bg,并有气体放出.试回答:
(1)ag沉淀的组成为(写化学式)BaCO3、BaSO4;在ag沉淀中加过量稀硝酸,发生的化学方程式为BaCO3+2HNO3═Ba(NO3)2+CO2↑+H2O;
(2)若a=43g,b=23.3g,则原溶液中,n(Na2CO3)=0.1mol,m(Na2SO4)=14.2g,
(3)若a=27.24g,b=23.3g,则产生的气体在标准状况下的体积为0.448L.
分析 (1)加入过量BaCl2溶液发生反应:BaCl2+Na2CO3═BaCO3↓+2NaCl、BaCl2+Na2SO4═BaSO4↓+2NaCl,ag沉淀为BaCO3、BaSO4质量之和,在ag沉淀中加过量稀硝酸,发生的化学方程式为:BaCO3+2HNO3═Ba(NO3)2+CO2↑+H2O;
(2)沉淀中加入硝酸,最终剩余固体为BaSO4,若a=43g,b=23.3g,则m(BaSO4)=23.3g,故m(BaCO3)=43g-23.3g=19.7g,根据n=$\frac{m}{M}$计算BaCO3、BaSO4的物质的量,根据碳酸根守恒计算Na2CO3物质的量,根据硫酸根守恒计算Na2SO4的物质的量,再根据m=nM计算Na2SO4的质量;
(3)m(BaCO3)=27.24g-23.3g=3.94g,根据n=$\frac{m}{M}$计算BaCO3的物质的量,根据碳原子守恒计算CO2物质的量,再根据V=nVm计算CO2的体积.
解答 解:(1)加入过量BaCl2溶液发生反应:BaCl2+Na2CO3═BaCO3↓+2NaCl、BaCl2+Na2SO4═BaSO4↓+2NaCl,ag沉淀为BaCO3、BaSO4质量之和,在ag沉淀中加过量稀硝酸,发生的化学方程式为:BaCO3+2HNO3═Ba(NO3)2+CO2↑+H2O,
故答案为:BaCO3、BaSO4;BaCO3+2HNO3═Ba(NO3)2+CO2↑+H2O;
(2)沉淀中加入硝酸,最终剩余固体为BaSO4,若a=43g,b=23.3g,则m(BaSO4)=23.3g,故m(BaCO3)=43g-23.3g=19.7g,根据碳酸根守恒,n(Na2CO3)=n(BaCO3)=$\frac{19.7g}{197g/mol}$=0.1mol,根据硫酸根守恒,n(Na2SO4)=n(BaSO4)=$\frac{23.3g}{233g/mol}$=0.1mol,则m(Na2SO4)=0.1mol×142g/mol=14.2g,
故答案为:0.1mol;14.2g;
(3)m(BaCO3)=27.24g-23.3g=3.94g,根据碳酸根守恒,n(Na2CO3)=n(BaCO3)=$\frac{3.94g}{197g/mol}$=0.02mol,根据碳原子守恒,n(CO2)=n(BaCO3)=0.02mol,故CO2的体积为0.02mol×22.4L/mol=0.448L,
故答案为:0.448L.
点评 本题考查混合物有关计算,明确发生的反应是解题关键,注意利用守恒法解答,题目难度不大.

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案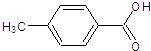 有多种同分异构体,其中符合属于酯类并含有苯环的同分异构体有( )种(不考虑立体异体)
有多种同分异构体,其中符合属于酯类并含有苯环的同分异构体有( )种(不考虑立体异体)| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
| A. | Ne、H2、O2 | B. | O2、N2、H2 | C. | NO、CO2、H2 | D. | NH3、O2、NO2 |
| A. | 将58.5gNaCl溶于1L水中可得1mol/L的NaCl溶液 | |
| B. | 将标准状况下22.4LHCl溶于1L水中可得1mol/L盐酸 | |
| C. | 将 25.0g胆矾溶于水后配成100mL溶液所得溶液浓度为1mol/L | |
| D. | 将 78gNa2O2溶于水,配成1L溶液可得到浓度为1mol/L溶液 |
| A. | NaCl溶液 | B. | Na2SiO3溶液 | C. | 氢氟酸 | D. | NaOH溶液 |
①少量的浓硫酸沾到皮肤上时,可用NaOH溶液中和
②取用少量化学药品时,应特别注意观察药品包装容器上的安全警示标记
③凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂
④闻任何化学药品的气味时都不能使鼻子凑近药品
⑤点燃氢气前要检查纯度,以免发生爆炸
⑥CO气体有毒,处理CO尾气的方法一般是将其点燃,转化成无毒的CO2
⑦在盛O2集气瓶中进行铁丝燃烧实验时,事先在集气瓶底铺上一层沙子.
| A. | ①②④⑤⑦ | B. | ②④⑤⑥⑦ | C. | ①④⑤⑥⑦ | D. | ②③④⑤⑦ |
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2 CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图:有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
写出吸收酸性气体的化学反应方程式CO2+2NaOH=Na2CO3+H2O;SO2+2NaOH=Na2SO3+H2O.
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用b洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去.
 .
.