��Ŀ����
����Ŀ����������͵����������Ǵ�������Ҫ��Ⱦ���ֹ��������Ի�������Ⱦ�ǵ�ǰ������������Ҫ�о�����֮һ��
��1��һ�������£�������Ӧ2SO2��g��+O2��g��2SO3��g������2L�ܱ�������ͨ��2mol SO2��g����1mol O2��g����0.2mol SO3��g����2min��Ӧ�ﵽƽ��ʱ�����SO2�����ʵ���Ϊ1mol����ÿ��淴Ӧ��ƽ�ⳣ��K=�������£������������ټ���2mol SO2��g���������´ﵽƽ��ʱSO2����ת���� 0%�����������������=������
��2����һ�ܱ������з�����Ӧ2NO22NO+O2��H��0����Ӧ������NO2��Ũ����ʱ��仯�������ͼ��ʾ��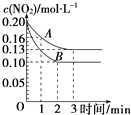
��ش�
��������A����Ӧ��ǰ3min��������ƽ����Ӧ����Ϊ ��
��������A��B�ֱ��ʾ���Ǹ÷�Ӧ��ij��ͬ�����µķ�Ӧ���������������������Ũ�ȡ�����ѹǿ�������¶ȡ�����������
��3��һ���¶��£����ܱ�������N2O5�ɷ������з�Ӧ��
��2N2O5��g��4NO2��g��+O2��g��
��2NO2��g��2NO��g��+O2��g��
����ƽ��ʱ��c��NO2��=0.4molL��1 �� c��O2��=1.3molL��1 �� ��Ӧ����NO2��ת����Ϊ �� N2O5��g������ʼŨ��Ӧ������ molL��1 ��
���𰸡�
��1��5.76����
��2��0.0117mol?L��1?min��1���¶�
��3��80%��1
���������⣺��1��һ�������£�2SO2��g��+O2��g��2SO3��g������2L�ܱ�������ͨ��2mol SO2��g����1mol O2��g����0.2mol SO3��g����2min��Ӧ�ﵽƽ��ʱ�����SO2�����ʵ���Ϊ1mol����
2SO2��g�� | + | O2��g�� | 2SO3��g�� | ||
��ʼ����mol/L�� | 1 | 0.5 | 0.1 | ||
�仯����mol/L�� | 0.5 | 0.25 | 0.5 | ||
ƽ������mol/L�� | 0.5 | 0.25 | 0.6 |
ƽ�ⳣ��K= ![]() =
= ![]() =5.76��
=5.76��
�����������ټ���2mol SO2��g����ƽ��������У�������������Ũ�ȱ���ʼ�������´ﵽƽ��ʱSO2����ת����С��50%��
���Դ��ǣ�5.76������
��2.����������A��ǰ3min��NO2��ƽ����Ӧ����V= ![]() =
= ![]() mol/��Lmin��=
mol/��Lmin��= ![]() mol/��Lmin��������Ϊ����֮�ȵ���ϵ��֮�ȣ�����������ƽ����Ӧ����Ϊ
mol/��Lmin��������Ϊ����֮�ȵ���ϵ��֮�ȣ�����������ƽ����Ӧ����Ϊ ![]() ��
�� ![]() mol/��Lmin��=0.0117mol/��Lmin����
mol/��Lmin��=0.0117mol/��Lmin����
���Դ��ǣ�0.0117 molL��1min��1��
����ͼ���֪B״̬��Ӧ�Ͽ죬��A��B���ڲ�ͬƽ��״̬���϶����Ǵ�����Ӱ�죬����ѹǿ��Ӱ�죬������ѹǿ��ƽ�����淴Ӧ�����ƶ�����NO2�����ʵ���Ӧ����B״̬NO2�����ʵ������٣�Ӧ�������¶ȵ�ԭ�÷�Ӧ������ӦΪ���ȷ�Ӧ�������¶�ƽ��������Ӧ�����ƶ�����NO2�����ʵ������٣�
���Դ��ǣ��¶ȣ���3�������Ӧ�ٺͷ�Ӧ�ڲ�����������Ũ�ȷֱ�ΪXmolL��1 �� Y molL��1 ��
2N2O5��g�� | 4NO2��g�� | + | O2��g�� | �� | |
2X | 4XmolL��1 | XmolL��1 |
2NO2��g�� | 2NO��g�� | + | O2��g�� | �� | |
2YmolL��1 | YmolL��1 |
������ϵ��X+Y=1.3��4X��2Y=0.4����ã�X=0.5��Y=0.8����Ӧ����NO2��ת����Ϊ ![]() ��100%=80%���ɢٷ�Ӧ���ɵ�O2��Ũ��Ϊ0.5 molL��1 �� ֪N2O5����ʼŨ��Ӧ����1 molL��1 �� N2O5����ʼŨ��Ӧ������1molL��1 ��
��100%=80%���ɢٷ�Ӧ���ɵ�O2��Ũ��Ϊ0.5 molL��1 �� ֪N2O5����ʼŨ��Ӧ����1 molL��1 �� N2O5����ʼŨ��Ӧ������1molL��1 ��
���Դ��ǣ�80%��1��
�����㾫����������Ĺؼ��������⻯ѧƽ��״̬���жϵ����֪ʶ������״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���ȣ��Լ��Ի�ѧƽ��ļ�������⣬�˽ⷴӦ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��

 �ŵ������ϵ�д�
�ŵ������ϵ�д� 53������ϵ�д�
53������ϵ�д�