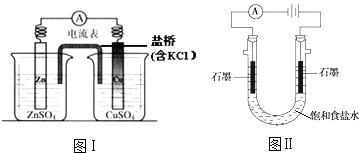
��Ŀ����
����Ŀ��50 mL 0.50 mol/L������50 mL 0.55 mol/L NaOH��Һ������ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺
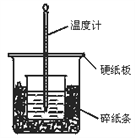
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��________��
��2���ձ���������ֽ����������________________________��
��3�����ձ����粻��Ӳֽ�壬��õ��к�����ֵ_____������ƫ������ƫС������Ӱ��������
��4��ʵ���и���60 mL 0.50 mol/L�����50 mL 0.55 mol/L NaOH��Һ���з�Ӧ��������ʵ����ȣ����ų�������________�����������������������������к���________��������������������������������______________________________________��
���𰸡� ���β�������� ����ʵ������е�������ʧ ƫС ����� ��� �������������������Լ�������Ķ����йأ�������![]() ��Һ��
��Һ��![]() ��Һ���з�Ӧ��������ʵ����ȣ�����ˮ�������࣬���ų�������ƫ�ߣ������к��ȵľ���ǿ���ǿ�Ӧ����
��Һ���з�Ӧ��������ʵ����ȣ�����ˮ�������࣬���ų�������ƫ�ߣ������к��ȵľ���ǿ���ǿ�Ӧ����![]() ˮʱ�ų����ȣ��к������
ˮʱ�ų����ȣ��к������
����������1�����к��Ȳⶨ�м������ȼƹ����֪����ȱ�ٻ��β����������
��2����ֽ���������Ǽ���ʵ�������������ʧ��ʹʵ��ⶨ���к�������С��
��3�����ձ�����Ӳֽ�壬��ʵ������оͻ���������ʧ���Ӷ�ʹ�¶ȼƲ�õ��¶�ƫ�ͣ�ʹ�к�����ֵƫС��
��4���к�����ָ�������кͷ�Ӧ����1 mol H2O���ų��������������������ء�

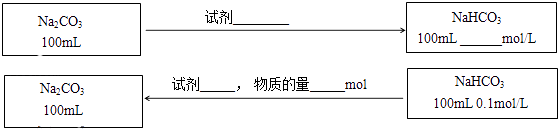
����Ŀ��ijͬѧ��ʵ�����о�Na2CO3��NaHCO3�����ʼ��ת����
��1���ֱ���Ũ�Ⱦ�Ϊ0.1mol/LNa2CO3��NaHCO3��Һ�еμӼ��η�̪�Լ���
��Na2CO3��Һ����ɫ��Ϊ��ɫ����ԭ���� ��
��NaHCO3��ҺҲ����ɫ��Ϊ��ɫ����ԭ���� ��
�۱Ƚ�������Һ����ɫ����ɫ��dz�������ѧʽ����
��2���о�NaHCO3��CaCl2�ķ�Ӧ��
ʵ����� | ʵ����� | ʵ������ |
ʵ��1 | ��2mL 0.001mol/L NaHCO3��Һ�м���1mL 0.1mol/LCaCl2��Һ | �����Ա仯���ü�������䣬û�г��ֹ�����ͨ·�� |
ʵ��2 | ��2mL 0.1mol/L NaHCO3��Һ�м���1mL 0.1mol/LCaCl2��Һ | ����ɫ���ȵĻ��ǣ��ü�������䣬���ֹ�����ͨ·�� |
��ʵ��1��û�г��ְ�ɫ���ǵ�ԭ���� ��
��ʵ��2���γɵķ�ɢϵ���� ��
�������ӷ���ʽ��ʾʵ��2�з����ķ�Ӧ ��
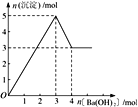
��3���ڲ������������ʵ�ǰ���£�ʵ��Na2CO3��NaHCO3֮���ת��������ͼ�б�����õ��Լ������������ʵ�Ũ�ȣ���Ӧǰ����Һ����ı仯�ɺ��ԣ���