��Ŀ����
����Ŀ�����ӹ�ҵ����30%��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ��������ӡˢ��·�塣
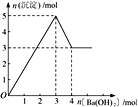
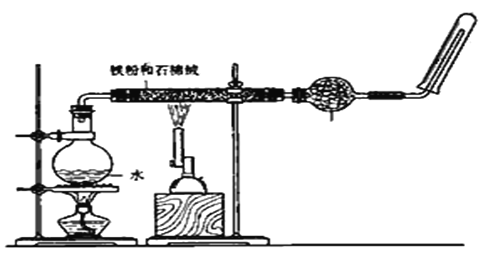
�ٰ�FeO��Fe2O3������������ϡ�����С���ͨ�����������������ȡFeCl3��Һ��FeO��Fe2O3����������ϡ�����У���������Һ��ͨ������������ʱ�����ķ�Ӧ����������ʽΪ ____________________����Ҫ������Һ��Fe3+����Ӧѡ�õ��Լ���_____________________��
��д��FeCl3��Һ�����ͭ������Ӧ�Ļ�ѧ����ʽ___________________________________����ת�Ƶ�����Ϊ6.02��1024ʱ�������������ʵ�����Ϊ_______________
���𰸡� FeO+2HCl=FeCl2+H2O��Fe2O3+6HCl=2FeCl3+3H2O��2Fe2++Cl2=2Fe3++2Cl�� KSCN��Һ Cu+2FeCl3=2FeCl2+CuCl2 320g
�����������������������ᷴӦ�����Ȼ��������Ȼ�������������Ӧ�����Ȼ��������ӷ���ʽ��FeO+2H+=Fe2++H2O��2Fe2++Cl2=2Fe3++2Cl-�������������ᷴӦ�����Ȼ��������ӷ���ʽ��Fe2O3+6H+=2Fe3++3H2O�����������������������������Ѫ��ɫ����������KSCN��Һ�������������ӵĴ��ڣ��ʴ�Ϊ��FeO+2H+=Fe2++H2O��Fe2O3+6H+=2Fe3++3H2O��2Fe2++Cl2=2Fe3++2Cl-�� KSCN��Һ��
���Ȼ�����ͭ��Ӧ�����Ȼ��������Ȼ�ͭ����Ӧ�Ļ�ѧ����ʽΪ��Cu+2FeCl3=2FeCl2+CuCl2�����ݷ���ʽ��Cu+2FeCl3=2FeCl2+CuCl2����֪ת��2mol���ӱ�������ͭ������Ϊ64g����ת�Ƶ�����Ϊ6.02��1024ʱ�������ʵ���Ϊ10molʱ����������ͭ������Ϊ64g/mol��![]() =320g���ʴ�Ϊ��2Fe3++Cu=2Fe2++Cu2+��320g��
=320g���ʴ�Ϊ��2Fe3++Cu=2Fe2++Cu2+��320g��

 ��ĩ���䵥Ԫ�����ิϰ��ϵ�д�
��ĩ���䵥Ԫ�����ิϰ��ϵ�д�