题目内容
(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式: 。
(2)已知反应N2(g)+3H2(g)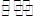 2NH3(g) △H=a kJ/mol。试根据表中所列键能数据估算a的数值: 。
2NH3(g) △H=a kJ/mol。试根据表中所列键能数据估算a的数值: 。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:
C(s,石墨)+O2(g) CO2(g) △H1=-393.5kJ?mol-1 ①
2H2(g)+O2(g) 2H2O(1) △H2=-571.6kJ?mol-1 ②
2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l) △H3 =-2599kJ?mol-1 ③
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变: 。
(2)已知反应N2(g)+3H2(g)
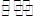 2NH3(g) △H=a kJ/mol。试根据表中所列键能数据估算a的数值: 。
2NH3(g) △H=a kJ/mol。试根据表中所列键能数据估算a的数值: 。| 化学键 | H—H | N—H | N=N |
| 键能(kJ/mol) | 436 | 391 | 945 |
已知:
C(s,石墨)+O2(g)
2H2(g)+O2(g)
2C2H2(g)+5O2(g)
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变: 。
(1)2CH3OH(1)+3O2(g)===2CO2(g)+4H2O(l) △H=-1452.8 kJ/mol
(2)-93 (3)△H=+226.7 kJ/mol
(2)-93 (3)△H=+226.7 kJ/mol
(1)甲醇燃烧化学方程式为:2CH3OH+3O2(g) 2CO2(g)+4H2O,故2mol甲醇燃烧放出的热量为
2CO2(g)+4H2O,故2mol甲醇燃烧放出的热量为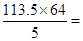 1452.8kJ,故热化学方程式为:2CH3OH(1)+3O2(g)===2CO2(g)+4H2O(l) △H=-1452.8 kJ/mol
1452.8kJ,故热化学方程式为:2CH3OH(1)+3O2(g)===2CO2(g)+4H2O(l) △H=-1452.8 kJ/mol
(2)△H=反应物的键能之和—生成物的键能之和=945+3×436—2×3×391=-93kJ/mol
(3)依据盖斯定律可知,2×①+②/2 —③/2:
2C(s,石墨)+H2(g)=C2H2(g) △H=+226.7 kJ/mol
 2CO2(g)+4H2O,故2mol甲醇燃烧放出的热量为
2CO2(g)+4H2O,故2mol甲醇燃烧放出的热量为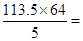 1452.8kJ,故热化学方程式为:2CH3OH(1)+3O2(g)===2CO2(g)+4H2O(l) △H=-1452.8 kJ/mol
1452.8kJ,故热化学方程式为:2CH3OH(1)+3O2(g)===2CO2(g)+4H2O(l) △H=-1452.8 kJ/mol(2)△H=反应物的键能之和—生成物的键能之和=945+3×436—2×3×391=-93kJ/mol
(3)依据盖斯定律可知,2×①+②/2 —③/2:
2C(s,石墨)+H2(g)=C2H2(g) △H=+226.7 kJ/mol

练习册系列答案
相关题目
 Ni(CO)4(g),该反应的△H______0 (选填“>”或“=”或“<”)。
Ni(CO)4(g),该反应的△H______0 (选填“>”或“=”或“<”)。 与温度(t)的关系曲线图。则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K=______________。800℃时,其中最易被还原的金属氧化物是___________,该反应的平衡常数数值(K)等于__________。
与温度(t)的关系曲线图。则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K=______________。800℃时,其中最易被还原的金属氧化物是___________,该反应的平衡常数数值(K)等于__________。
 CH3OH(g) △H=-90.7 kJ·mol-1
CH3OH(g) △H=-90.7 kJ·mol-1 2H2O,试回答下列问题。
2H2O,试回答下列问题。 ΔH3<0
ΔH3<0 成甲醇:CO(g)+2H2(g)
成甲醇:CO(g)+2H2(g) CH3OH(g);ΔH
CH3OH(g);ΔH ,
,