题目内容
(9分)甲醇是一种可再生能源,具有广泛的开发和应用前景。
⑴工业上一般采用下列反应合 成甲醇:CO(g)+2H2(g)
成甲醇:CO(g)+2H2(g) CH3OH(g);ΔH
CH3OH(g);ΔH
①下列数据是在不同温度下的化学平衡常数(K)。
由表中数据判断ΔH 0(填“>”、“=”或“<”=。)
②250℃,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得:
CO剩余0.4mol,求K1。
⑵已知在常温常压下:①CH3OH(l)+O2(g)=CO(g)+2H2O(l);△H=-442.8KJ/mol
②2CO(g)+O2(g)=2CO2(g);ΔH2 =-566.0kJ/mol
写出甲醇燃烧热的热化学方程式____________________________________________,
⑶某实验小组依据甲醇燃烧的反应原理,设计如图(A)所示的燃料电池装置。则:
①该燃料电池负极的电极反应为:___________________________ ,
,
②用该甲醇燃料电池对B池进行电解,己知c、d是质量相同的铜棒,电解2min后,取出c、d,洗净、烘干、称量,质量差为0.64g,在通电过程中,电路中通过的电子为_________mol。
⑴工业上一般采用下列反应合
 成甲醇:CO(g)+2H2(g)
成甲醇:CO(g)+2H2(g) CH3OH(g);ΔH
CH3OH(g);ΔH①下列数据是在不同温度下的化学平衡常数(K)。
| 250℃: K1=__________ | 300℃: K2=0.270 | 350℃: K3=0.012 |
②250℃,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得:
CO剩余0.4mol,求K1。
⑵已知在常温常压下:①CH3OH(l)+O2(g)=CO(g)+2H2O(l);△H=-442.8KJ/mol
②2CO(g)+O2(g)=2CO2(g);ΔH2 =-566.0kJ/mol
写出甲醇燃烧热的热化学方程式____________________________________________,
⑶某实验小组依据甲醇燃烧的反应原理,设计如图(A)所示的燃料电池装置。则:
①该燃料电池负极的电极反应为:___________________________
 ,
,②用该甲醇燃料电池对B池进行电解,己知c、d是质量相同的铜棒,电解2min后,取出c、d,洗净、烘干、称量,质量差为0.64g,在通电过程中,电路中通过的电子为_________mol。

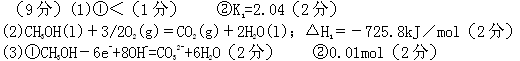
略

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
 2NH3(g)能量变化如右图,回答下列问题:
2NH3(g)能量变化如右图,回答下列问题:
 2NH3(g) △H=a kJ/mol。试根据表中所列键能数据估算a的数值: 。
2NH3(g) △H=a kJ/mol。试根据表中所列键能数据估算a的数值: 。 0分)汽车尾气中含有CO、NO2
0分)汽车尾气中含有CO、NO2 等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化成无毒气体。
等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化成无毒气体。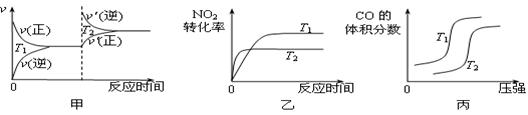 ΔH= ▲ 。对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是 ▲
ΔH= ▲ 。对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是 ▲  (填代号)。
(填代号)。 3H2(g)+N2(g) △H="(3a+c-6b)" kJ/mol
3H2(g)+N2(g) △H="(3a+c-6b)" kJ/mol 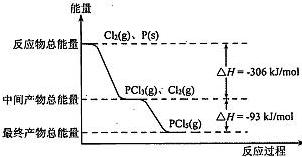
 =CO2(g) △H2=-393.5kJ/mol
=CO2(g) △H2=-393.5kJ/mol