题目内容
【题目】现有一定量的镁铝合金与100 mL 稀硝酸充分反应,在反应过程中无气体放出。在反应结束后的溶液中,逐滴加入1.00mol/ L NaOH溶液,加入NaOH 溶液的体积与产生沉淀的物质的量关系如图所示:
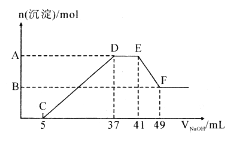
(1)合金中的铝与稀硝酸反应的化学方程式为_________;
(2)纵坐标上A 点数值是__________,B 点数值是_________;
(3)原HNO3 溶掖的物质的量浓度为_________。
【答案】 8Al+30HNO3=8Al(NO3)3+3NH4NO3+9H2O 0.012 0.004 0.45mol/L
【解析】在镁铝与稀硝酸反应后的混合溶液中滴加1.00mol/ L NaOH溶液,当沉淀量最多时,继续滴加NaOH溶液,最初沉淀量不减少,说明溶液中含有NH4+,发生的离子反应为NH4++OH-=NH3·H2O;
(1)合金中铝与稀硝酸反应生成硝酸铝和硝酸铵,发生反应的化学方程式为8Al+30HNO3=8Al(NO3)3+3NH4NO3+9H2O;
(2)EF阶段发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,消耗NaOH的物质的量为(49mL-41mL)×10-3L/mol×1.00mol/ L=0.008mol,则生成Al(OH)3的物质的量为0.008mol,CD段发生离子反应生成Mg(OH)2 和Al(OH)3,共消耗NaOH的物质的量为(37mL-5mL)×10-3L/mol×1.00mol/ L=0.032mol,则生成Mg(OH)2 的物质的量为(0.032mol-0.008mol×3)÷2=0.004mol,故纵坐标A点生成沉淀的总物质的量为0.008mol+0.004mol=0.012mol,B点为Mg(OH)2 的物质的量为0.004mol;
(3)DE段消耗NaOH的物质的量为(41mL-37mL)×10-3L/mol×1.00mol/ L=0.004mol,则溶液中含有NH4NO3的物质的量为0.004mol,D点溶液为NaNO3和NH4NO3的混合溶液,NaNO3的物质的量等于D点加入NaOH的总物质的量,即为37mL×10-3L/mol×1.00mol/ L=0.037mol,根据原子守恒可知,原硝酸的物质的量为0.037mol+0.004mol×2=0.045mol,HNO3 溶掖的物质的量浓度为![]() =0.45mol/L。
=0.45mol/L。