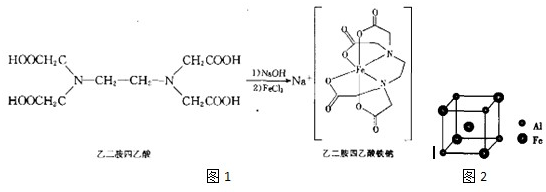
题目内容
12.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 加入铝粉放出H2的溶液中:Al3+、K+、SO42-、Cl- | |
| B. | 1.0 mol•L-1的KNO3溶液中:Na+、Fe2+、Cl-、SO42- | |
| C. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| D. | 水电离产生的c(OH-)=10-12 mol•L-1的溶液中:K+、Cu2+、SO42-、NO3- |
分析 A.加入铝粉能放出H2的溶液可能呈碱性也可能呈酸性,注意酸性时NO3-的性质;
B.离子之间不反应的能大量共存;
C.和铁离子反应的离子之间不反应;
D.水电离产生的c(OH-)=10-12 mol•L-1的溶液呈酸性或碱性.
解答 解:A.加入铝粉能放出H2的溶液可能呈碱性也可能呈酸性,如果呈碱性,则铝离子不能大量共存,故A错误;
B.离子之间不反应的能大量共存,离子之间不反应,所以一定能大量共存,故B正确;
C.和铁离子反应的离子之间不反应,硫氰根离子和铁离子发生络合反应而不能大量共存,故C错误;
D.水电离产生的c(OH-)=10-12 mol•L-1的溶液呈酸性或碱性,如果呈碱性,则铜离子不能大量共存,故D错误;
故选B.
点评 本题考查离子共存,为高频考点,明确离子性质及离子共存条件是解本题关键,侧重考查复分解反应、络合反应,易错选项是A,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.如图为以SCY陶瓷固体为电解质的电化学合成氨装置,将该装置的底部置于加热炉内保持570℃的高温.将氨气通往陶瓷内筒,将氢气通过陶瓷内筒和石英外筒间的空隙.下列说法正确的是( )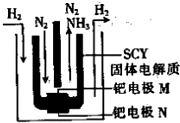

| A. | 钯电极N为正极 | |
| B. | 钯电极M上发生氧化反应 | |
| C. | SCY陶瓷固体电解质中H+移向钯电极N | |
| D. | 电池总反应方程式为N2+3H2═2NH3 |
17.氮化钠(Na3N)晶体熔融时能导电.下列描述正确的是( )
| A. | 构成晶体的两种微粒电子层结构相同 | |
| B. | 构成晶体的两种微粒半径相等 | |
| C. | 构成晶体的两种微粒的核外电子能量相同 | |
| D. | 构成晶体的两种微粒的电子层数不同 |
2.X、Y、Z是短周期是三种相邻元素,X与Y同主族,Y与Z同周期,已知三种元素族序数之和为17,原子序数之和为39,则X、Y、Z的元素符号为( )
| A. | Na、K、Ca | B. | N、P、S | C. | O、S、P | D. | F、Cl、S |
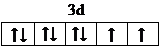 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①乙烯、②H乙炔、③苯、④甲醛.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是加成产物CH3OH分子之间能形成氢键(须指明加成产物是何物质)
,很多不饱和有机物在E催化下可与H2发生加成反应:如①乙烯、②H乙炔、③苯、④甲醛.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是加成产物CH3OH分子之间能形成氢键(须指明加成产物是何物质)
 DCH3COOOH
DCH3COOOH .
.