题目内容
(8分)I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是 腐蚀(填“析氢”或“吸氧”)。
(2)写出铁锅腐蚀正极的电极反应式: 。
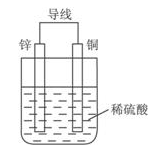
II.(1)某同学运用所学知识,自选材料设计实验,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑。
请你在方框内画出能够实现这一反应的装置图。
(2)某同学在做一定条件下铜与稀硫酸的反应实验时,看到碳棒上有气泡产生,但铜棒却没有被腐蚀。请你分析其原因: 。
I.(1)吸氧(1分)
(2)2H2O+O2+4e-= 4OH- (2分)
II.(1)如图(3分)
(2)两极与电源的正负极接反了,或铜棒接电源的负极了等(2分)
解析试题分析:I.(1)铁锅表面溶液为中性,发生吸氧腐蚀。
(2)正极上O2得电子:2H2O+O2+4e-= 4OH-。
II.(1)根据化学方程式:Cu+H2SO4(稀)=CuSO4+H2↑,Cu失电子应为阳极,所以Cu与外加电源的正极相连,电解质为H2SO4溶液,进而可画出装置图,
(2)铜棒却没有被腐蚀,说明铜棒没有作阳极,可能为:两极与电源的正负极接反了,或铜棒接电源的负极了等。
考点:本题考查钢铁的腐蚀、电极方程式的书写、装置图的绘画、实验现象的分析。

工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: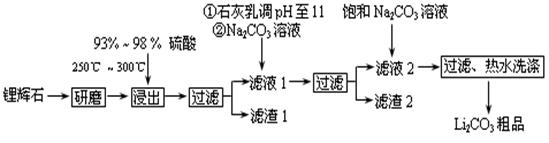
已知:①Li2O·Al2O3·4SiO2 + H2SO4(浓)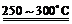 Li2SO4 + Al2O3·4SiO2·H2O↓
Li2SO4 + Al2O3·4SiO2·H2O↓
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
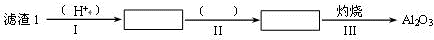
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3,写出生成滤渣2反应的离子方程式: 。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
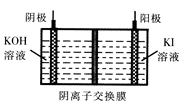
①将粗产品Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解。阳极的电极反应式是 。
②电解后向产品LiOH溶液中加入过量NH4HCO3溶液生成Li2CO3反应的化学方程式是 。
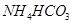 溶液呈碱性,30℃以上溶液中
溶液呈碱性,30℃以上溶液中
 沉淀是否完全的方法是__________________________________。
沉淀是否完全的方法是__________________________________。 晶体分离出来用到过滤操作,过滤时用到的主要玻璃仪器是__________________________。
晶体分离出来用到过滤操作,过滤时用到的主要玻璃仪器是__________________________。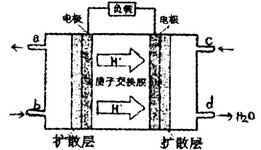



 2HX(g) (X2表示Cl2、Br2和I2)。
2HX(g) (X2表示Cl2、Br2和I2)。