题目内容
如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
(1)甲烷燃料电池负极电极反应式是:
(2)石墨电极(C)的电极反应式为
(3)若在标准状况下,有2. 24 L氧气参加反应,则乙装置中铁电极上生成的气体体积为_ L;丙装置中阴极析出铜的质量为 g
(4)某同学利甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。若用于制漂白液时a为电池_ 极,电解质溶液最好用_ 。若用于制 Fe(OH)2,使用硫酸钠做电解质溶液,阳极选用 作电极。
(1)CH4-8e-+10OH-=CO32-+7H2O
(2)2Cl--2e-=Cl2↑
(3)4.48 12.8
(4)负 饱和氯化钠溶液或食盐水 铁
解析试题分析:甲为燃料电池,甲烷通入一极为负极,氧气通入一极为正极;乙为电解池,Fe为阴极,C为阳极,实质为电解饱和食盐水;丙为电解池,粗铜为阳极,精铜为阴极,实质为精炼铜。
(1)注意在碱性环境中进行的电极反应产物为CO32-;
(2)石墨电极(C)的电极为阳极,阴离子放电;
(3)标准状况下,2.24L氧气的物质的量为0.1mol,参与反应转移电子数为0.4mol ;铁电极为阴极,阳离子放电:2H++2e-=H2,则放出氢气0.2mol,即为4.48L;丙装置中阴极反应式为:Cu2++2e-=Cu,则析出铜0.2mol,即为12.8g。
(4)用于制漂白液时利用电解饱和氯化钠溶液或食盐水,同时利用生成的NaOH溶液吸收生成的Cl2进而生成漂白液,因此Cl2要在B极生成才可被NaOH溶液吸收完全。 用于制Fe(OH)2时需要铁做阳极放电生成亚铁离子:Fe-2e-=Fe2+
考点:电化学的基础知识。

下列有关同分异构体数目的叙述中,不正确的是( )
| A.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 |
| B.分子式符合C5H11Cl的化合物有6种 |
| C.已知二氯苯有3种同分异构体,则四氯苯的同分异构体的数目为3种 |
D.菲的结构简式为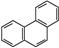 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
 3Zn(OH)2+2Fe(OH)3+4KOH,按要求回答下列问题:
3Zn(OH)2+2Fe(OH)3+4KOH,按要求回答下列问题:

 。
。

