题目内容
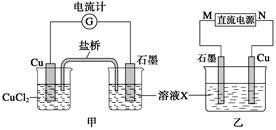
根据铜锌原电池示意图,回答下列问题:
(1)锌为 极,电极反应式为 ;铜为 极,电极反应 为 ,原电池总离子反应式是 。
(2)若以该电池作为电源,以石墨碳棒为电极电解CuCl2溶液,在电池的工作过程中,Zn极质量变化了3.25g,则Cu极质量 (填“增加”、“不变”或“减少”);电子从电池的锌极沿导线流向电解池的 (填“阴极”或“阳极”,下同);在电解池中Cu2+向 移动,在该电极上析出铜的质量为 g。
(正、负极每空1分,其余每空2分)
(1)负 , Zn-2e-==Zn2+,正, 2H++2e-==H2↑, Zn+2H+==Zn2++H2↑;
(2) 不变,阴极、阴极,3.2
解析试题分析:(1)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,锌负极,反应式为Zn-2e-==Zn2+。铜时正极,溶液中的氢离子在正极得到电子,反应式为2H++2e-==H2↑。正负极反应式相加就是总反应式,即Zn+2H+==Zn2++H2↑。
(2)由于正极是氢离子得到电子,所以铜电极质量是不变的。和电源负极相连的是电解池的阴极,即电子从电池的锌极沿导线流向电解池的阴极,所以溶液中的阳离子向阴极移动,即铜离子在阴极放电形成铜,根据电子的得失守恒可知,形成铜的质量是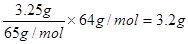 。
。
考点:该题考查原电池原理的运用和相关计算。

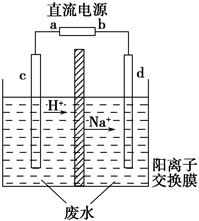
安徽凹山铁矿坐落在马鞍山境内,矿床属于陆相火山一侵入岩型铁矿床,俗称“玢岩型”铁矿,是马钢重要的矿区之一。铁矿中被称为红帘石的铁矿含锰量高,锰是冶炼锰钢的重要原料。红帘石主要成分有磁铁矿Fe3O4、菱铁矿FeCO3、锰矿(MnO2和MnCO3)石棉Mg3Si3O7(OH)4等。工业上将红帘石处理后运用阴离子膜电解法的新技术提取金属锰并制的绿色高效水处理剂(K2FeO4)。工业流程如下:
(1)工业上为提高稀硫酸浸取效率一般采取的措施是(任意写两种方法)
① ②
(2)石棉化学式为Mg3Si3O7(OH)4也可以表示成氧化物形式,氧化物表达式为 。
(3)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
| 离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.3 |
| 完全沉淀的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
过程②中加氨水调节溶液的pH等于6,则滤渣B的成分 。
(4)浸出液中以Mn2+形式存在,且滤渣A中无MnO2原因 。
(5)电解装置中箭头表示溶液中阴离子移动的方向;则A电极是直流电源的 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为 。

(6)滤渣经反应④生成绿色高效水处理剂的离子方程式 。
K2FeO4被誉为绿色高效水处理剂的原因是 。
 CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH