题目内容
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式: 或
或
 或
或 .
.
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)
a.MnO2 b.AlCl3 c.Na2SO3 d.KMnO4
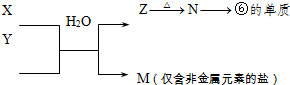
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为
(6)已知破坏1mol N≡N键、H-H键、N-H键分别需要吸收的能量为946kJ、436kJ、391kJ.则1molN2完全反应转化为NH3共
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
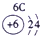
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
Na>Al>O
Na>Al>O
(用元素符号表示).(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
HNO3>H2CO3>H2SiO3
HNO3>H2CO3>H2SiO3
.(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式:
 或
或
 或
或
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)
a
a
.a.MnO2 b.AlCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
,N→⑥的单质的化学方程式为2Al2O3(熔融)
4Al+3O2↑
| ||
| 冰晶石 |
2Al2O3(熔融)
4Al+3O2↑
.
| ||
| 冰晶石 |
(6)已知破坏1mol N≡N键、H-H键、N-H键分别需要吸收的能量为946kJ、436kJ、391kJ.则1molN2完全反应转化为NH3共
放出
放出
(填“吸收”或“放出”)能量92
92
kJ.分析:(1)同周期元素原子半径逐渐减小,电子层越多半径越大;
(2)根据元素的非金属性强弱比较酸性的强弱;
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物有NaOH、NaClO、NaClO3等物质;
(4)Na2SO3具有还原性,与过氧化氢反应生成钠硫酸,高锰酸钾具有氧化性,氧化过氧化氢生成氧气,不能用来做催化剂,氯化铝对水的分解无影响;
(5)⑥为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应;
(6)旧键断裂吸收的能量和新键生成释放的能量之差即为反应的能量变化值,并根据化学键的形成和断裂所需能量大小来判断反应吸放热.
(2)根据元素的非金属性强弱比较酸性的强弱;
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物有NaOH、NaClO、NaClO3等物质;
(4)Na2SO3具有还原性,与过氧化氢反应生成钠硫酸,高锰酸钾具有氧化性,氧化过氧化氢生成氧气,不能用来做催化剂,氯化铝对水的分解无影响;
(5)⑥为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应;
(6)旧键断裂吸收的能量和新键生成释放的能量之差即为反应的能量变化值,并根据化学键的形成和断裂所需能量大小来判断反应吸放热.
解答:解:根据元素在周期表中的位置可判断元素的种类,①为H元素,②为C元素,③为N元素,④为O元素,⑤为Na元素,⑥为Al元素,⑦为Si元素,⑧为Cl元素.
(1)电子层越多半径越大,所以O半径最小,同周期元素原子半径从左到右逐渐减小,即Na>Al,故答案为:Na>Al>O;
(2)元素周期表中,同周期从左到右元素的非金属性逐渐增强,同主族从上到下元素的非金属性逐渐减弱,则非金属性的强弱顺序为N>C>Si,非金属性越强,对应最高价氧化物的水化物的酸性越强,故有酸性HNO3>H2CO3>H2SiO3,故答案为:HNO3>H2CO3>H2SiO3;
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物有NaOH、NaClO、NaClO3等物质,属于离子化合物,故答案为: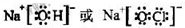 ;
;
(4)过氧化氢在MnO2、FeCl3等做催化剂的条件下易发生分解生成氧气,而Na2SO3具有还原性,与过氧化氢反应生成钠硫酸,高锰酸钾具有氧化性,氧化过氧化氢生成氧气,不能用来做催化剂,氯化铝对水的分解无影响,不能作催化剂,故答案为:a;
(5)由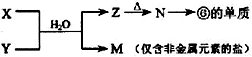 反应转化可知,⑥为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应,X溶液与Y溶液反应的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+;工业冶炼铝用电解氧化铝的方法,反应方程式为2Al2O3(熔融)
反应转化可知,⑥为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应,X溶液与Y溶液反应的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+;工业冶炼铝用电解氧化铝的方法,反应方程式为2Al2O3(熔融)
4Al+3O2↑,
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;2Al2O3(熔融)
4Al+3O2↑;
(6)反应热=吸收的总能量-放出的总能量,所以1mol N2生成NH3的反应热=946kJ+3×436 kJ-2×3×391kJ=-92kJ,所以是放出热量,故答案为:放出;92.
(1)电子层越多半径越大,所以O半径最小,同周期元素原子半径从左到右逐渐减小,即Na>Al,故答案为:Na>Al>O;
(2)元素周期表中,同周期从左到右元素的非金属性逐渐增强,同主族从上到下元素的非金属性逐渐减弱,则非金属性的强弱顺序为N>C>Si,非金属性越强,对应最高价氧化物的水化物的酸性越强,故有酸性HNO3>H2CO3>H2SiO3,故答案为:HNO3>H2CO3>H2SiO3;
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物有NaOH、NaClO、NaClO3等物质,属于离子化合物,故答案为:
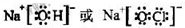 ;
;(4)过氧化氢在MnO2、FeCl3等做催化剂的条件下易发生分解生成氧气,而Na2SO3具有还原性,与过氧化氢反应生成钠硫酸,高锰酸钾具有氧化性,氧化过氧化氢生成氧气,不能用来做催化剂,氯化铝对水的分解无影响,不能作催化剂,故答案为:a;
(5)由
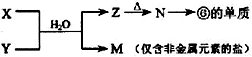 反应转化可知,⑥为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应,X溶液与Y溶液反应的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+;工业冶炼铝用电解氧化铝的方法,反应方程式为2Al2O3(熔融)
反应转化可知,⑥为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应,X溶液与Y溶液反应的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+;工业冶炼铝用电解氧化铝的方法,反应方程式为2Al2O3(熔融)
| ||
| 冰晶石 |
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;2Al2O3(熔融)
| ||
| 冰晶石 |
(6)反应热=吸收的总能量-放出的总能量,所以1mol N2生成NH3的反应热=946kJ+3×436 kJ-2×3×391kJ=-92kJ,所以是放出热量,故答案为:放出;92.
点评:本题考查学生元素周期表的结构和元素周期律的知识,综合性较强,难度较大.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案
相关题目








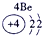
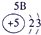
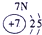
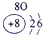
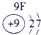
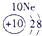
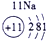





 表示的是
表示的是