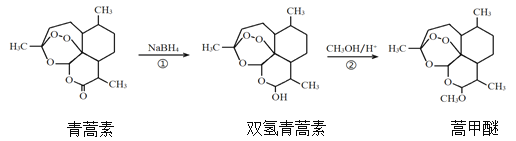
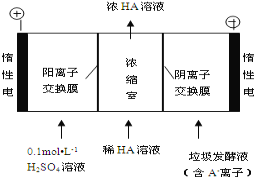
题目内容
【题目】在一定温度、压强下,向密闭容器中投入一定量N2和H2,发生反应:N2+3H2![]() 2NH3 △H<0。
2NH3 △H<0。
(1)反应开始阶段,v(正)______(填“>”“<”或“=”)v(逆),随后v(正)逐渐______ (填“增大”或“减小”,下同),v(逆)逐渐______,反应达到平衡时,v(正)______ (填“>”“<”或“=”)v(逆)。
(2)达到平衡后,若正反应速率用v(N2)表示,逆反应速率用v’(H2)表示,则v(N2)=____v’(H2)。
(3)下列措施中能加快反应速率并提高氢气的转化率的是______(填字母)。
A.其他条件不变时,压缩容器体积 B.其他条件不变时,升高反应体系温度
C.使用合适的催化剂 D.保持容器体积不变,充入一定量的氮气
(4)实际生产中往往需要将温度控制在一个合适的范围,分析温度不宜过高也不宜过低的原因是______________________________________。
(5)写出合成氨反应N2+3H2![]() 2NH3的平衡常数表达式:____________________,升高温度时K值______(填“增大”“减小”或“不变”)。
2NH3的平衡常数表达式:____________________,升高温度时K值______(填“增大”“减小”或“不变”)。
【答案】> 减小 增大 = ![]() AD 升高温度平衡逆向移动,不利于提高N2的转化率,但温度过低,反应速率缓慢, K=
AD 升高温度平衡逆向移动,不利于提高N2的转化率,但温度过低,反应速率缓慢, K=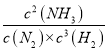 减小
减小
【解析】
(1)反应开始阶段,正反应速率大于逆反应速率,随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大,达到平衡时,正逆反应速率相等;
(2)达到平衡时正逆反应速率相等,且满足反应速率之比等于化学计量数之比;
(3)一般来说,升高温度、增大浓度、缩小体积以及加入催化剂等,可加快反应速率,再结合温度、压强和催化剂对平衡的影响分析;
(4)可结合温度对速率和平衡的影响分析;
(5)平衡常数为生成物浓度幂之积与反应物浓度幂之积的比值。
(1)反应开始阶段,正反应速率大于逆反应速率,随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大,达到平衡时,正逆反应速率相等;
(2)达到平衡时正逆反应速率相等,且满足反应速率之比等于化学计量数之比,则V(N2)=![]() v'(H2);
v'(H2);
(3) A.其他条件不变时,压缩容器体积,压强增大,反应速率加快,且平衡正向移动,H2的转化率增大,故A正确;
B.其他条件不变时,升高反应体系温度,反应速率加快,但平衡逆向移动,H2的转化率减小,故B错误;
C.使用合适的催化剂,加快反应速率,不影响平衡的移动,H2的转化率不变,故C错误;
D.保持容器体积不变,充入一定量的氮气,氮气的浓度增大,反应速率加快,且平衡正向移动,H2的转化率增大,故D正确;
故答案为AD;
(4)反应N2+3H2![]() 2NH3 △H<0,升高温度平衡逆向移动,不利于提高N2的转化率,但温度过低,反应速率缓慢,故实际生产中往往需要将温度控制在一个合适的范围,即综合考虑转化率和反应速率;
2NH3 △H<0,升高温度平衡逆向移动,不利于提高N2的转化率,但温度过低,反应速率缓慢,故实际生产中往往需要将温度控制在一个合适的范围,即综合考虑转化率和反应速率;
(5)平衡常数为生成物浓度幂之积与反应物浓度幂之积的比值,K=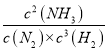 ,当温度升高时,平衡逆向移动,平衡常数K值减小。
,当温度升高时,平衡逆向移动,平衡常数K值减小。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案