题目内容
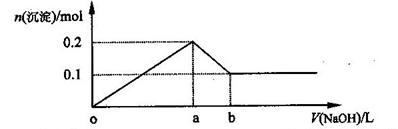
向10ml0.1mol/l的Na[Al(OH)4]溶液中滴加0.1mol/l的HCl溶液,生成沉淀的量与加入的盐酸体积的关系如图

(1)写出OA段的离子方程式
(2)写出AB段的化学方程式
(3)OB段反应共消耗 ml盐酸溶液;
此过程中生成沉淀最多时,沉淀物质的量是 mol,此时消耗的盐酸是 ml

(1)写出OA段的离子方程式
(2)写出AB段的化学方程式
(3)OB段反应共消耗 ml盐酸溶液;
此过程中生成沉淀最多时,沉淀物质的量是 mol,此时消耗的盐酸是 ml
(1)[Al(OH)4]-+ H+ = Al(OH)3↓+H2O(2分)
(2)Al(OH)3 + 3HCl = AlCl3+ 3H2O (2分)
(3)40 0.001 10(每空2分)
(2)Al(OH)3 + 3HCl = AlCl3+ 3H2O (2分)
(3)40 0.001 10(每空2分)
由图,得:OA段,Na[Al(OH)4]+HCl=" NaCl+" Al(OH)3↓+ H2O
AB段,Al(OH)3+3HCl= AlCl3+3H2O
(3)n(Na[Al(OH)4])=1.0×10-3mol, OB段: Na[Al(OH)4]——4 HCl,则:n(HCl)= 4.0×10-3mol,
V(HCl)= 4.0×10-3mol/0.1mol/l=4.0×10-2L=40ml;
到A点时,生成沉淀最多:Na[Al(OH)4]+HCl=" NaCl+" Al(OH)3↓+ H2O
沉淀物质的量= n(Na[Al(OH)4])=1.0×10-3mol=0.001mol
消耗的V(盐酸)= 1.0×10-3mol/0.1mol/l=10ml;
AB段,Al(OH)3+3HCl= AlCl3+3H2O
(3)n(Na[Al(OH)4])=1.0×10-3mol, OB段: Na[Al(OH)4]——4 HCl,则:n(HCl)= 4.0×10-3mol,
V(HCl)= 4.0×10-3mol/0.1mol/l=4.0×10-2L=40ml;
到A点时,生成沉淀最多:Na[Al(OH)4]+HCl=" NaCl+" Al(OH)3↓+ H2O
沉淀物质的量= n(Na[Al(OH)4])=1.0×10-3mol=0.001mol
消耗的V(盐酸)= 1.0×10-3mol/0.1mol/l=10ml;

练习册系列答案
 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目