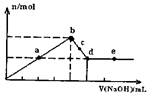
题目内容
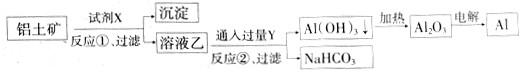
(8分)工业上用铝土矿(主要成分为Al2O3,还有Fe2O3、SiO2)提取氧化铝做冶炼铝的原料,提取的操作过程如下:
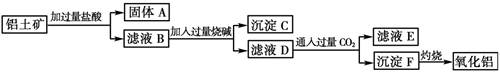
(1)铝合金的用途是 ;(写出两种即可)
(2)写出加入盐酸后生成Al3+的离子方程式:
(3)写出固体A中加入烧碱后生成SiO32-的离子方程式:
(4)验证滤液B中含Fe3+,取少量滤液B并加入 (填试剂名称)

(1)铝合金的用途是 ;(写出两种即可)
(2)写出加入盐酸后生成Al3+的离子方程式:
(3)写出固体A中加入烧碱后生成SiO32-的离子方程式:
(4)验证滤液B中含Fe3+,取少量滤液B并加入 (填试剂名称)
(1)建筑业、容器、包装业、交通运输、电子行业等(2分)(写出一点给1分,但最多只给两分)
(2)Al2O3 +6 H+ = 2Al3+ + 3H2O (2分) (3)SiO2 + 2OH- = SiO32- + H2O (2分)
(4)硫氰化钾或硫氰酸钾(2分)
(2)Al2O3 +6 H+ = 2Al3+ + 3H2O (2分) (3)SiO2 + 2OH- = SiO32- + H2O (2分)
(4)硫氰化钾或硫氰酸钾(2分)
本实验目的为提纯铝土矿,除去杂质Fe2O3、SiO2,获得纯氧化铝;
分析整个实验流程:
第一步.加过量稀盐酸,溶解成铝盐铁盐,过滤,除去不溶的杂质二氧化硅,引入氢离子、氯离子。
第二步. 加过量氢氧化钠使铝盐变成偏铝酸盐, 而铁离子转化为沉淀,过滤除去,引入氢氧根除去氢离子;
第三步.通入过量二氧化碳 生成沉淀氢氧化铝;
第四步.高温灼烧,氢氧化铝受热分解成氧化铝和水。
相关方程式:反应1:Al2O3+6HCl=2AlCl3+3H2O SiO2+2NaOH=Na2SiO3+H2O
反应2:Al2O3+2NaOH=2NaAlO2+H2O SiO2+2NaOH=Na2SiO3+H2O
反应3:2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓
反应4:2Al(OH)3==Al2O3+3H2O
分析整个实验流程:
第一步.加过量稀盐酸,溶解成铝盐铁盐,过滤,除去不溶的杂质二氧化硅,引入氢离子、氯离子。
第二步. 加过量氢氧化钠使铝盐变成偏铝酸盐, 而铁离子转化为沉淀,过滤除去,引入氢氧根除去氢离子;
第三步.通入过量二氧化碳 生成沉淀氢氧化铝;
第四步.高温灼烧,氢氧化铝受热分解成氧化铝和水。
相关方程式:反应1:Al2O3+6HCl=2AlCl3+3H2O SiO2+2NaOH=Na2SiO3+H2O
反应2:Al2O3+2NaOH=2NaAlO2+H2O SiO2+2NaOH=Na2SiO3+H2O
反应3:2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓
反应4:2Al(OH)3==Al2O3+3H2O

练习册系列答案
相关题目
 HCO3- + H+ Ka1(H2CO3) = 4.45×10-7
HCO3- + H+ Ka1(H2CO3) = 4.45×10-7