题目内容
17.某同学欲在实验室中对Fe3+与I-的反应进行探究,实现Fe2+与Fe3+的相互转化.(1)该同学最初的实验操作和现象如下:
| 编号 | 操作 | 现象 |
| I | 先向2mL 0.1mol/L FeCl2溶液中滴加KSCN溶液,再滴加新制氯水 | |
| II | 先向2mL 0.1mol/L FeCl3溶液中滴加KSCN溶液,再滴加0.1mol/L KI溶液 |
②FeCl2溶液与新制氯水反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-.
(2)该同学在进行实验I时,加入的氯水过多,导致出现的红色又褪去,则可能的原因是过量氯水将KSCN(Fe3+)氧化.
分析 (1)①铁离子和硫氰根离子反应生成红色的络合物,导致溶液呈红色;碘离子能还原铁离子;
②亚铁离子与氯气反应生成铁离子和氯离子;
(2)根据氯气具有强氧化性分析.
解答 解:(1)①铁离子和硫氰根离子反应生成红色的络合物,导致溶液呈红色,所以先向2mL 0.1mol/L FeCl3溶液中滴加KSCN溶液,溶液变红色,碘离子能还原铁离子生成亚铁离子和单质碘,则溶液的红色褪去;
故答案为:滴加KSCN溶液显红色,滴入KI后红色褪去;
②亚铁离子与氯气反应生成铁离子和氯离子,其反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(2)加入的氯水过多,导致出现的红色又褪去,说明KSCN(Fe3+)被反应了,由于氯气具有强氧化性,则过量氯水将KSCN(Fe3+)氧化,从而使溶液褪色;
故答案为:过量氯水将KSCN(Fe3+)氧化.
点评 本题考查了亚铁离子和铁离子之间的相互转化,难度不大,铁离子和亚铁离子的检验是高考的热点,根据铁离子和亚铁离子的特征反应来检验即可.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
8.浓硫酸、稀硫酸分别与下列物质混合时,开始反应的本质肯定不同的是( )
| A. | Na2SO3 | B. | Fe(OH)3 | C. | Na2O | D. | Zn |
5.下列说法正确的是( )


| A. | 氯化钠固体不导电,所以氯化钠是非电解质 | |
| B. | 向纯水中加入碳酸钠能使水的电离平衡正向移动,水的离子积增大 | |
| C. | 如右图研究的是铁的吸氧腐蚀,实验中红色首先在食盐水滴的中心出现 | |
| D. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s) 的△H<0△S<0 |
12. 普通锌锰干电池的简图(如图所示),它是用锌皮制成的锌筒作电极兼做容器,中央插一根碳棒,碳棒顶端加一铜帽.在石墨碳棒周围填满二氧化锰和炭黑的混合物,并用离子可以通过的长纤维纸包裹作隔膜,隔膜外是用氯化锌、氯化铵和淀粉等调成糊状作电解质溶液;该电池工作时的总反应为:Zn+2NH4++2MnO2═[Zn(NH3)2]2++Mn2O3+H2O关于锌锰干电池的下列说法中正确的是( )
普通锌锰干电池的简图(如图所示),它是用锌皮制成的锌筒作电极兼做容器,中央插一根碳棒,碳棒顶端加一铜帽.在石墨碳棒周围填满二氧化锰和炭黑的混合物,并用离子可以通过的长纤维纸包裹作隔膜,隔膜外是用氯化锌、氯化铵和淀粉等调成糊状作电解质溶液;该电池工作时的总反应为:Zn+2NH4++2MnO2═[Zn(NH3)2]2++Mn2O3+H2O关于锌锰干电池的下列说法中正确的是( )
 普通锌锰干电池的简图(如图所示),它是用锌皮制成的锌筒作电极兼做容器,中央插一根碳棒,碳棒顶端加一铜帽.在石墨碳棒周围填满二氧化锰和炭黑的混合物,并用离子可以通过的长纤维纸包裹作隔膜,隔膜外是用氯化锌、氯化铵和淀粉等调成糊状作电解质溶液;该电池工作时的总反应为:Zn+2NH4++2MnO2═[Zn(NH3)2]2++Mn2O3+H2O关于锌锰干电池的下列说法中正确的是( )
普通锌锰干电池的简图(如图所示),它是用锌皮制成的锌筒作电极兼做容器,中央插一根碳棒,碳棒顶端加一铜帽.在石墨碳棒周围填满二氧化锰和炭黑的混合物,并用离子可以通过的长纤维纸包裹作隔膜,隔膜外是用氯化锌、氯化铵和淀粉等调成糊状作电解质溶液;该电池工作时的总反应为:Zn+2NH4++2MnO2═[Zn(NH3)2]2++Mn2O3+H2O关于锌锰干电池的下列说法中正确的是( )| A. | 当该电池电压逐渐下降后,利用电解原理能重新充电复原 | |
| B. | 电池负极的电极反应式为:2MnO2+2NH4++2e-═Mn2O3+2NH3+H2O | |
| C. | 该电池碳棒可用铜棒代替,但是工作电压会下降 | |
| D. | 外电路中每通过0.1 mol电子,锌的质量理论上减小6.5g |
2.下列关于二氧化硫和二氧化碳的说法中,正确的是( )
| A. | 二者都可导致温室效应 | B. | 二者都能与Na2CO3溶液反应 | ||
| C. | 二者都既具有氧化性又具有还原性 | D. | 二者都具有漂白性 |
6.(1)为了达到下表中的实验要求,请从“供选择的化学试剂及方法”栏中,选择正确选项的字母代号从上往下依次填入对应的空格中.
(2)现有A、B、C三种气体,A在一定条件下能与O2反应生成B,B不溶于水,但却能与O2反应生成C,A和C都能溶于水,前者呈碱性,后者呈酸性,两者水溶液相混合得到了D的溶液,写出A、B、C、D的化学式A:NH3,B:NO,C:NO2,D:NH4NO3.
| 序号 | 实验要求 | 答案 | 供选择的化学试剂及方法 |
| a | 检验乙酸是否具有酸性 | A.新制的氢氧化铜悬浊液 | |
| b | 检验植物油中是否含有碳碳双键 | B.紫色石蕊试液 | |
| c | 检验尿液中是否含有葡萄糖 | C.加入饱和Na2CO3溶液,分液 | |
| d | 除去乙酸乙酯中的少量乙酸 | D.溴水 |
7.在表示苯分子结构的“凯库勒式”中,碳原子之间出现了“单双交替”结构,类似的 (环辛四烯)也具有单双交替的结构,但前者具有“芳香性”,后者无芳香性,且后者可使Br2水或酸性KMnO4溶液褪色,这里的有“芳香性”的理解最合理的是( )
(环辛四烯)也具有单双交替的结构,但前者具有“芳香性”,后者无芳香性,且后者可使Br2水或酸性KMnO4溶液褪色,这里的有“芳香性”的理解最合理的是( )
 (环辛四烯)也具有单双交替的结构,但前者具有“芳香性”,后者无芳香性,且后者可使Br2水或酸性KMnO4溶液褪色,这里的有“芳香性”的理解最合理的是( )
(环辛四烯)也具有单双交替的结构,但前者具有“芳香性”,后者无芳香性,且后者可使Br2水或酸性KMnO4溶液褪色,这里的有“芳香性”的理解最合理的是( )| A. | 该物质具有的芳香性气味 | |
| B. | 能萃取溴水中的溴 | |
| C. | 能使溴水或酸性KMnO4溶液褪色的性质 | |
| D. | 分子中含有的碳碳键是介于碳碳单键和双键之间的独特的键 |

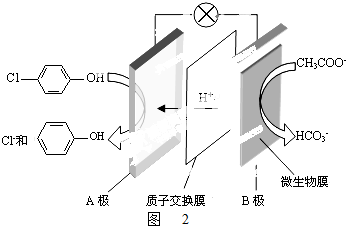
 )的废水可以利用微生物电池除去,其原理如图2所示.
)的废水可以利用微生物电池除去,其原理如图2所示. +Cl-.
+Cl-.