题目内容
煤制备CH4是一种有发展前景的新技术.
I.煤炭气化并制备CH4包括以下反应.
C(s)+H2O(g)=CO(g)+H2(g)△H1=+131kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g)△H2=-41kJ/mol
CO(g)+3H2(g)=CH4(g)+H2O(g)△H3=-206kJ/mol
(1)写出煤和气态水制备CH4(产物还有CO2)的热化学方程式 .
(2)煤转化为水煤气(CO和H2)作为燃料和煤直接作为燃料相比,主要的优点有 .
(3)写出甲烷-空气燃料电池(电解质溶液为KOH溶液)中负极的电极反应式 .
Ⅱ.对以上反应CO(g)+H2O(g)?CO2(g)+H2(g)△H2=-41kJ/mol,起始时在密闭容器中充入1.00mol CO和1.00mol H2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响).实验条件如下表:
(1)实验①中c(CO2)随时间变化的关系见下图,请在答题卡的框图中,画出实验②和③中c(CO2)随时间变化关系的预期结果示意图.

(2)在与实验①相同的条件下,起始时充入容器的物质的量:n(CO)=n(H2O)=n(CO2)=n( H2)=1.00mol.通过计算,判断出反应进行的方向.(写出计算过程.)
I.煤炭气化并制备CH4包括以下反应.
C(s)+H2O(g)=CO(g)+H2(g)△H1=+131kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g)△H2=-41kJ/mol
CO(g)+3H2(g)=CH4(g)+H2O(g)△H3=-206kJ/mol
(1)写出煤和气态水制备CH4(产物还有CO2)的热化学方程式
(2)煤转化为水煤气(CO和H2)作为燃料和煤直接作为燃料相比,主要的优点有
(3)写出甲烷-空气燃料电池(电解质溶液为KOH溶液)中负极的电极反应式
Ⅱ.对以上反应CO(g)+H2O(g)?CO2(g)+H2(g)△H2=-41kJ/mol,起始时在密闭容器中充入1.00mol CO和1.00mol H2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响).实验条件如下表:
| 实验编号 | 容器体积/L | 温度/℃ |
| ① | 2.0 | 1200 |
| ② | 2.0 | 1300 |
| ③ | 1.0 | 1200 |

(2)在与实验①相同的条件下,起始时充入容器的物质的量:n(CO)=n(H2O)=n(CO2)=n( H2)=1.00mol.通过计算,判断出反应进行的方向.(写出计算过程.)
考点:热化学方程式,原电池和电解池的工作原理,物质的量或浓度随时间的变化曲线
专题:基本概念与基本理论
分析:Ⅰ、(1)根据盖斯定律来解答本题;
(2)气态物质燃烧时更充分,产生的污染物少;
(3)在碱性甲烷燃料电池中,甲烷在负极放电,生成CO32-,据此写出电极反应式;
Ⅱ、(1)实验②与①相比温度不变,体积增大,则压强减小,速率减慢,平衡不移动;实验③与②相比较压强不变,温度升高,速率加快,平衡正移;
(2)通过题目所给的信息,计算出此温度下的化学平衡常数的数值,并与浓度商做对比,从而得出反应进行的方向.
(2)气态物质燃烧时更充分,产生的污染物少;
(3)在碱性甲烷燃料电池中,甲烷在负极放电,生成CO32-,据此写出电极反应式;
Ⅱ、(1)实验②与①相比温度不变,体积增大,则压强减小,速率减慢,平衡不移动;实验③与②相比较压强不变,温度升高,速率加快,平衡正移;
(2)通过题目所给的信息,计算出此温度下的化学平衡常数的数值,并与浓度商做对比,从而得出反应进行的方向.
解答:
解:I.(1)根据盖斯定律可知,将①×2+②+③可得:2C(s)+2H2O(g)=CH4 (g)+CO2 (g)△H=(+131kJ/mol)×2+(-41kJ/mol)+(-206kJ/mol)=+15 kJ/mol,
故答案为:2C(s)+2H2O(g)=CH4 (g)+CO2 (g)△H=+15 kJ/mol
(2)煤转化为水煤气(CO和H2)作为燃料时,燃烧更充分,煤的利用率更高,产生的污染物少,
故答案为:提高煤的利用率(节约能源或节约资源)、减少污染;
(3)在碱性甲烷燃料电池中,甲烷在负极放电,考虑到是碱性环境,故生成CO32-,故负极反应式为:CH4-8e-+10OH-=CO32-+7H2O,故答案为:CH4-8e-+10OH-=CO32-+7H2O;
Ⅱ、(1)实验②与①相比温度不变,体积增大,则压强减小,速率减慢,平衡不移动,体积增大一倍,浓度时原来的一半;实验③与②相比较压强不变,温度升高,速率加快,平衡逆向移动,二氧化碳的浓度减小,但小于实验①的浓度,据此画图为: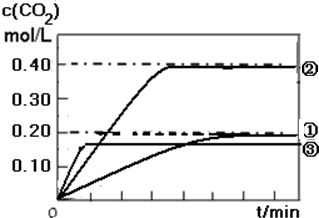 故答案为:
故答案为:
(2)平衡时n(CO2)=0.20mol/L×2.0L=0.40mol
CO(g)+H2O(g) CO2 (g)+H2(g)
CO2 (g)+H2(g)
起始物质的量/mol 1.00 1.00 1.00 1.00
变化物质的量/mol 0.40 0.40 0.40 0.40
平衡物质的量/mol 0.60 0.60 0.40 0.40
故平衡常数 K═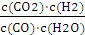 =
=
=0.44
起始时充入容器的物质的量,n(CO)=n(H2O)=n(CO2)=n( H2)=1.00mol时,C(CO)=C(H2O)=C(CO2)=C( H2)=0.5mol/L,
此时浓度商Qc=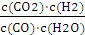 =
=
=1.0
可知Qc>K,故反应向逆反应方向(生成CO和H2O的方向)进行,故答案为:反应向逆反应方向进行.
故答案为:2C(s)+2H2O(g)=CH4 (g)+CO2 (g)△H=+15 kJ/mol
(2)煤转化为水煤气(CO和H2)作为燃料时,燃烧更充分,煤的利用率更高,产生的污染物少,
故答案为:提高煤的利用率(节约能源或节约资源)、减少污染;
(3)在碱性甲烷燃料电池中,甲烷在负极放电,考虑到是碱性环境,故生成CO32-,故负极反应式为:CH4-8e-+10OH-=CO32-+7H2O,故答案为:CH4-8e-+10OH-=CO32-+7H2O;
Ⅱ、(1)实验②与①相比温度不变,体积增大,则压强减小,速率减慢,平衡不移动,体积增大一倍,浓度时原来的一半;实验③与②相比较压强不变,温度升高,速率加快,平衡逆向移动,二氧化碳的浓度减小,但小于实验①的浓度,据此画图为:
 故答案为:
故答案为:
(2)平衡时n(CO2)=0.20mol/L×2.0L=0.40mol
CO(g)+H2O(g)
 CO2 (g)+H2(g)
CO2 (g)+H2(g)起始物质的量/mol 1.00 1.00 1.00 1.00
变化物质的量/mol 0.40 0.40 0.40 0.40
平衡物质的量/mol 0.60 0.60 0.40 0.40
故平衡常数 K═
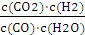 =
=| 0.4mol/L×0.4mol/L |
| 0.6mol/L×0.6mol/L |
起始时充入容器的物质的量,n(CO)=n(H2O)=n(CO2)=n( H2)=1.00mol时,C(CO)=C(H2O)=C(CO2)=C( H2)=0.5mol/L,
此时浓度商Qc=
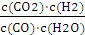 =
=| 0.5mol/L×0.5mol/L |
| 0.5mol/L×0.5mol/L |
可知Qc>K,故反应向逆反应方向(生成CO和H2O的方向)进行,故答案为:反应向逆反应方向进行.
点评:本题综合考查了利用盖斯定律来计算反应热、燃料电池电极反应式的书写和反应方向的判断,并考查了图象问题,综合性较强,难度较大.

练习册系列答案
相关题目
“绿色化学”要求化学反应尽可能不产生“副产物”,下列反应最符合“绿色化学”要求的是( )
| A、苯乙烯在一定条件下制聚苯乙烯 |
| B、乙醇与浓硫酸共热制乙烯 |
| C、乙醇催化氧化制乙醛 |
| D、乙烷与氯气反应制氯乙烷 |