题目内容
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。常温常压下,E单质是淡黄色固体,常在火山口附近沉积。
(1)D在元素周期表中的位置为____________,C和E离子半径大小比较______________。
(2)A2E的燃烧热ΔH = -a kJ/mol,写出A2E燃烧反应的热化学方程式:_______________。
(3)CA的电子式为 ___________;AB形成的晶体熔点_______。(填“大于”“小于”或“无法判断”)CE形成的晶体熔点。
(4)甲、乙、丙分别是B、D、E三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应的产物不同。写出向丙溶液中缓慢滴加过量的乙溶液过程中反应的离子方程式:________ 。
(1)第三周期 ⅢA族; Na+<S2- (2)Na+[:H]- 小于
(3)H2S(g)+3/2O2(g)=SO2(g)+H2O(l) △H=-akJ/mol
(4)4H++AlO2-=Al3++2H2O Al3++3AlO2-+6H2O=4Al(OH)3↓
解析试题分析:根据题意可知A是H;B是C;C是Na;D是Al; E是S。(1)Al原子序数为13,核外电子排布为2、8、3,在元素周期表中位于第三周期第ⅢA。Na+核外电子排布为2、8;S2-核外电子排布为2、8、8,对于电子层结构不同的离子来说,离子核外的电子层数越多,离子半径越大。所以这两种离子的半径大小关系为r(Na+)<r(S2-).(2)H2S燃烧反应的热化学方程式为H2S(g)+3/2O2(g)=SO2(g)+H2O(l) △H=-akJ/mol。(3)NaH是离子化合物,其电子式为Na+[:H]-。C、H两元素可以形成CH4、C2H4、C2H2等多种共价化合物,它们都是通过分子间作用力结合而成的分子晶体;而Na、S形成的化合物Na2S是通过离子键结合而成的离子晶体。由于离子键是一种强烈的相互作用,断裂需要消耗较高的能量。所以熔点、沸点比前者形成的分子晶体高很多。(4)根据题意可知甲、乙、丙分别是Na2CO3、NaAlO2、NaHSO4. 向NaHSO4溶液中缓慢滴加过量的NaAlO2溶液过程中反应的离子方程式为4H++AlO2-=Al3++2H2O、Al3++3AlO2-+6H2O=4Al(OH)3↓。
考点:考查元素的推断;元素的位置、结构、性质的关系;离子半径的比较、电子式、化学方程式、离子方程式及热化学方程式的书写等知识。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。
| 元素 | 信息 |
| B | 其单质在常温下为双原子分子,与A可形成分 子X,X的水溶液呈碱性 |
| D | 其简单阳离子与X具有相同电子数,且是同周 期中简单阳离子中半径最小的 |
| E | 元素原子最外层比次外层少2个电子 |
| C、F | 两种元素的原子最外层共有13个电子 |
则:(1)B的原子结构示意图为 。
(2)B、C、E分别与A形成的化合物中最稳定的是 (写化学式)。
(3)C与D形成的化合物的化学式是 ,它的性质决定了它在物质的分类中应属于 ;请写出该化合物对应水化物电离的方程式 。
(4)F的单质在反应中常作 剂,该单质的水溶液与E的低价氧化物反应的离子方程式 。
部分中学化学常见元素原子结构及性质如表所示:
| 序号 | 元素 | 结构及性质 |
| ① | A | A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5 |
| ② | B | B原子最外层电子数是内层电子总数的 |
| ③ | C | C是常见化肥的主要元素,单质常温下呈气态 |
| ④ | D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| ⑤ | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 |
| ⑥ | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
(1)A原子在周期表中的位置为________。
(2)B与C形成的化合物的化学式为________,它属于________化合物(填“离子”或“共价”)。
(3)F与E可以形成10电子和18电子的两种化合物X和Y,区别X与Y的水溶液的实验方法是________________________________________________________________。
(4)C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱_____________________________________________________________。
(5)列举一个实验事实证明A、B两种元素单质还原性的强弱_________________________________________________________________。
元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)用元素代号标出它们在周期表中的对应位置(以下为周期表的一部分)。
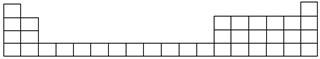
(2)B元素处于周期表中________周期________族。
(3)B的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为______________________________________________。
(4)上述五种元素的最高价氧化物对应水化物中酸性最强的是________(填化学式)。
(5)C、E形成的化合物为________(填化学式)。