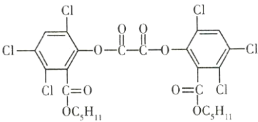
题目内容
【题目】三氧化二钴(Co2O3)常用于制滤光眼镜的添加剂、催化剂和强氧化剂。以含钴废料(主要成分CoO、Co2O3,含有少量MnO2、NiO、Fe3O4)为原料制备Co2O3的流程如下:

(1)研磨的目的是____________。滤渣1的主要成分为______________(填化学式)。
(2)酸浸时双氧水的作用有___________。不能用盐酸代替硫酸的原因是_________________。
(3)在实验室里,萃取操作要用到的玻璃仪器主要有___________。
(4)沉钴时发生反应的离子方程式为_______。煅烧时发生反应的化学方程式为_______。
【答案】增大固体与液体的接触面积,使酸浸速率更快,酸浸更充分 MnO2 亚铁离子氧化为铁离子 Co2O3可能与盐酸反应生成氯气 分液漏斗、烧杯 3NH3·H2O+2Co2++HCO3-=Co2(OH)2CO3↓+H2O+3NH4+ ![]()
【解析】
由流程可知,含钴废料主要成分为CoO、Co2O3,含有少量MnO2、NiO、Fe3O4,“研磨”可增大接触面积,加硫酸、过氧化氢后过滤分离出MnO2,加入过氧化氢氧化亚铁离子,酸浸分离出的溶液含Ni2+、Fe3+、Co2+,然后调pH分离出滤渣1为Fe(OH)3沉淀,再加萃取剂萃取分离出有机相含Ni2+,水相含Co2+,水相中加入碳酸氢铵、氨水生成Co2(OH)2CO3,再灼烧生成Co2O3,以此解答该题。
(1)研磨”的目的为增大接触面积,加快溶解速率,滤渣1为MnO2,故答案为:增大接触面积,加快溶解速率;MnO2;
(2)“酸浸”时,加入H2O2的量需适当超过理论值的原因为可保证Fe2+被完全氧化;Co2O3与盐反应生成Cl2有毒会污染空气,所以不能用盐酸代替硫酸, 故答案为:亚铁离子氧化为铁离子;Co2O3可能与盐酸反应生成氯气;
(3)萃取操作要用到的玻璃仪器主要有分液漏斗、烧杯,故答案为:分液漏斗、烧杯;
(4)沉钴”时发生反应的离子方程式为3NH3·H2O+2Co2++HCO3-=Co2(OH)2CO3↓+H2O+3NH4+,煅烧时发生反应的化学方程式为![]() 。
。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 平衡时,乙中CO2的转化率大于60%
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.008 mol·L-1
D. 反应开始时,乙中的反应速率最快,甲中的反应速率最慢