题目内容
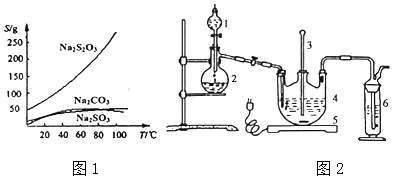
【题目】硫代硫酸钠可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S=Na2S2O3,常温下溶液中析出晶体为Na2S2O35H2O,Na2S2O35H2O于4045℃熔化,48℃分解:Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图1所示。
I.现按如下方法制备Na2S2O35H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓硫酸,在装置2中加入亚硫酸钠固体,并按如图2示安装好装置。
(1)仪器2的名称为___,装置6中可加入___。
A.BaCl2溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.NaOH溶液
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
①Na2CO3+SO2═Na2SO3+CO2
②Na2S+SO2+H2O═Na2SO3+H2S
③2H2S+SO2═3S↓+2H2O
④Na2SO3+S![]() Na2S2O3
Na2S2O3
总反应为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通SO2气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7的理由是:___(用文字和相关离子方程式表示)。
Ⅱ.分离Na2S2O35H2O并测定含量:
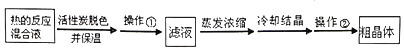
(3)为减少产品的损失,操作①为___,操作②是抽滤洗涤、干燥,其中洗涤操作是用___(填试剂名称)作洗涤剂。
(4)蒸发浓缩滤液,直至溶液呈微黄色浑浊为止。蒸发时要控制温度不宜过高,其原因是___。
(5)制得的粗产品中往往含有少量杂质。为了测定粗产品中Na2S2O35H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定杂质与酸性KMnO4溶液不反应)。称取1.28g粗样品溶于水,用(0.40mol/LKMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O![]() 全部被氧化时,消耗KMnO4溶液20.00mL。(5S2O
全部被氧化时,消耗KMnO4溶液20.00mL。(5S2O![]() +8MnO
+8MnO![]() +14H+=8Mn2++10SO
+14H+=8Mn2++10SO![]() +7H2O)
+7H2O)
试回答:
①滴定终点时的颜色变化___
②产品中Na2S2O35H2O的质量分数为___
【答案】蒸馏烧瓶 CD Na2S2O3在酸性环境中不能稳定存在,发生反应:S2O![]() +2H+=S↓+SO2+H2O 趁热过滤 乙醇 温度过高会导致析出的晶体分解 溶液由无色变为浅红色,半分钟内不褪色 96.9%
+2H+=S↓+SO2+H2O 趁热过滤 乙醇 温度过高会导致析出的晶体分解 溶液由无色变为浅红色,半分钟内不褪色 96.9%
【解析】
I.蒸馏烧瓶中浓硫酸和亚硫酸钠反应生成二氧化硫,在三颈烧瓶中二氧化硫、硫化钠、碳酸钠反应生成硫代硫酸钠,Na2S2O3在酸性环境中不稳定,容易分解得到S与二氧化硫,二氧化硫不易过量,碳酸钠可以反应掉氢离子,防止溶液呈酸性,尾气中有未反应的二氧化硫,在装置⑥中用氢氧化钠溶液或酸性高锰酸钾溶液吸收;
Ⅱ.所得热的反应混合溶液加活性炭脱色并保温,然后趁热过滤除去活性炭,适当加热但控制温度不超过40℃进行蒸发浓缩,然后冷却结晶、抽滤、洗涤得粗Na2S2O35H2O晶体。
I.(1)仪器2的名称为蒸馏烧瓶,装置6吸收未反应的SO2,防止污染空气:
A.SO2不能和BaCl2溶液反应,不能被吸收,A不满足题意;
B.SO2不能被浓硫酸吸收,B不满足题意;
C.SO2具有还原性,可以被酸性KMnO4溶液吸收,C满足题意;
D.SO2是酸性氧化物,能与NaOH溶液反应,可被NaOH溶液吸收,D满足题意;
故答案为:蒸馏烧瓶;CD;
(2)当溶液pH<7时,溶液显示酸性,会发生反应:S2O32-+2H+=S↓+SO2↑+H2O,所以Na2S2O3在酸性环境中不能稳定存在,应该使溶液的pH不小于7,故答案为:Na2S2O3在酸性环境中不能稳定存在,发生反应:S2O32-+2H+=S↓+SO2+H2O;
(3)常温下溶液中析出晶体为Na2S2O35H2O,为了避免过滤时析出Na2S2O35H2O晶体导致产率降低,操作①过滤除去活性炭时需要趁热过滤,洗涤时为减少Na2S2O35H2O晶体损失,依据Na2S2O3易溶于水,不溶于乙醇的性质选择乙醇洗涤,且洗涤后乙醇易挥发,不引入新的杂质,故答案为:趁热过滤;乙醇;
(4)由于Na2S2O35H2O于40~45℃熔化,48℃分解,所以蒸发时温度过高会导致析出的晶体分解,降低了产率,故答案为:温度过高会导致析出的晶体分解;
(1)①到达终点时,再滴入一滴高锰酸钾溶液,高锰酸钾不能被消耗,溶液由无色变为浅红色,且半分钟内不褪色,故答案为:溶液由无色变为浅红色,半分钟内不褪色;
②20.00mL 0.40mol/L KMnO4溶液中含有高锰酸钾的物质的量为:n(KMnO4)=0.40mol/L×0.02L=0.008mol,根据反应:5S2O32-+8MnO4-+14H+═8Mn2++10SO42-+7H2O,可知1.28g的粗样品含有Na2S2O35H2O的物质的量为:n(Na2S2O35H2O)=n(S2O32-)=![]() =0.005mol,产品中Na2S2O35H2O的质量分数=
=0.005mol,产品中Na2S2O35H2O的质量分数=![]() =96.9%,故答案为:96.9%。
=96.9%,故答案为:96.9%。

【题目】Ⅰ.(1)纯水在100 ℃时,pH=6,该温度下0.1mol·L-1的NaOH溶液中,pH= _____,由水电离出的c(OH-)= ___mol·L-1。
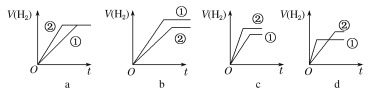
(2)常温下,有pH相同、体积相同的醋酸和盐酸两种溶液分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是________(填字母)。(①表示盐酸,②表示醋酸)
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
已知:25 ℃时,等浓度的HCN溶液、H2CO3溶液和CH3COOH溶液,三种溶液的pH由大到小的顺序为____________
(4)常温时,pH=4的盐酸和pH=9的氢氧化钠溶液混合,若所得混合溶液的pH=7,则盐酸和氢氧化钠溶液的体积比为_______。
Ⅱ.实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.1000 | 15.12 | 20.00 |
2 | 0.1000 | 14.98 | 20.00 |
3 | 0.1000 | 14.90 | 20.00 |
(1)配制10mL 0 .1000mol/L NaOH标准溶液.
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
①滴定达到终点的现象是______________________。
②根据上述数据,可计算出该盐酸的浓度约为______________(保留两位有效数字),
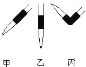
③排去碱式滴定管中气泡方法如图所示,应采用操作____________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
④在上述实验中,下列操作(其他操作正确)分别对测定结果造成什么影响?(填“偏低”、“偏高”、“无影响”)
A.滴定终点读数时俯视读数___________。
B.碱式滴定管尖嘴部分有气泡,滴定后消失_______________。