题目内容
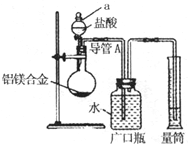 含镁3%~5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要材料.现有一块质量为m g的铝镁合金,欲测定其中镁的质量分数,几位同学设计了不同的实验方案.
含镁3%~5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要材料.现有一块质量为m g的铝镁合金,欲测定其中镁的质量分数,几位同学设计了不同的实验方案.方案1:铝镁合金
| 过量盐酸 |
方案2:铝镁合金
| 过量NaOH溶液 |
方案3:铝镁合金
| 过量盐酸 |
| 过量NaOH溶液 |
(Ⅰ)某化学实验小组利用右图所示实验装置,按照方案1进行了实验,请回答下列问题:
①装置中仪器a的名称是
分液漏斗
分液漏斗
.②实验装置中有一处明显错误,请指出
广口瓶中进气导管插入到了水中,排水导管未插至广口瓶底部
广口瓶中进气导管插入到了水中,排水导管未插至广口瓶底部
.(Ⅱ)方案2中发生反应的离子方程式为
2Al+2OH-+2H2O═2AlO2-+3H2↑
2Al+2OH-+2H2O═2AlO2-+3H2↑
.(Ⅲ)方案3“过滤”操作中用到的玻璃棒的作用是
引流
引流
.若按方案3进行试验,测得镁的质量分数为
| 3W2 |
| 5m |
| 3W2 |
| 5m |
(Ⅳ)某同学有设计了与上述方案不同的方案4,也测得了镁的质量分数.请你在括号内填上合适的内容,将该方案补充完整.
方案4:铝镁合金
| () |
分析:(Ⅰ)①a是分液漏斗;
②广口瓶的排水导管进入的应该在液面以上,出的导管应该在液面以下;
(Ⅱ)金属铝能够和强碱溶液反应生成偏铝酸盐;
(Ⅲ)根据玻璃棒在过滤中的作用完成;根据沉淀是氢氧化镁,求出氢氧化镁的物质的量,利用镁原子守恒,计算出合金中镁的质量分数;
(Ⅳ)可以利用铝和氢氧化钠溶液反应生成的氢气体积计算合金中镁的质量分数.
②广口瓶的排水导管进入的应该在液面以上,出的导管应该在液面以下;
(Ⅱ)金属铝能够和强碱溶液反应生成偏铝酸盐;
(Ⅲ)根据玻璃棒在过滤中的作用完成;根据沉淀是氢氧化镁,求出氢氧化镁的物质的量,利用镁原子守恒,计算出合金中镁的质量分数;
(Ⅳ)可以利用铝和氢氧化钠溶液反应生成的氢气体积计算合金中镁的质量分数.
解答:解:(Ⅰ))①根据图示不难看出,仪器a名称是分液漏斗,故答案为:分液漏斗;
②由于是根据排出的水的体积来测定生成的气体的体积,因此广口瓶中的进气管应该刚露出橡皮塞,而出气管应伸入到瓶底,
故答案为:广口瓶中进气导管插入到了水中,排水导管未插至广口瓶底部;
(Ⅱ)铝和氢氧化钠溶液反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(Ⅲ)玻璃棒在过滤中的作用,让滤液沿着玻璃棒流下,起到引流作用;由于氢氧化钠过量,W2g沉淀是氢氧化镁,物质的量是:
mol,
镁的质量分数为:
×100%=
×100%
故答案为:引流作用;
×100%;
(Ⅳ)利用氢氧化钠溶液和金属铝反应产生氢气,根据标况下氢气的体积,计算出铝的物质的量,再求出镁的质量分数,
故答案为:过量氢氧化钠溶液.
②由于是根据排出的水的体积来测定生成的气体的体积,因此广口瓶中的进气管应该刚露出橡皮塞,而出气管应伸入到瓶底,
故答案为:广口瓶中进气导管插入到了水中,排水导管未插至广口瓶底部;
(Ⅱ)铝和氢氧化钠溶液反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(Ⅲ)玻璃棒在过滤中的作用,让滤液沿着玻璃棒流下,起到引流作用;由于氢氧化钠过量,W2g沉淀是氢氧化镁,物质的量是:
| W2 |
| 40 |
镁的质量分数为:
| ||
| m |
| 3W2 |
| 5m |
故答案为:引流作用;
| 3W2 |
| 5m |
(Ⅳ)利用氢氧化钠溶液和金属铝反应产生氢气,根据标况下氢气的体积,计算出铝的物质的量,再求出镁的质量分数,
故答案为:过量氢氧化钠溶液.
点评:本题考查了测定镁铝合金中镁的质量分数方法,涉及了某些金属的化学性质及有关的化学方程式的计算,培养学生的分析能力和理解能力,本题难度中等.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
 含镁3%~5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要材料.现有一块质量为m g的铝镁合金,欲测定其中镁的质量分数,几位同学设计了不同的实验方案.
含镁3%~5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要材料.现有一块质量为m g的铝镁合金,欲测定其中镁的质量分数,几位同学设计了不同的实验方案.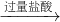 测定生成气体在标准状况下的体积(V1L)
测定生成气体在标准状况下的体积(V1L)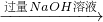 充分反应后测定剩余固体的质量(W1g)
充分反应后测定剩余固体的质量(W1g)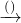 测定生成气体在标准状况下的体积(V2L).
测定生成气体在标准状况下的体积(V2L).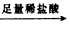 测定生成气体的体积(标准状况)
测定生成气体的体积(标准状况)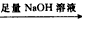 测定生成气体的体积(标准状况)
测定生成气体的体积(标准状况)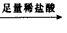 溶液
溶液 过滤,测定沉淀的质量
过滤,测定沉淀的质量