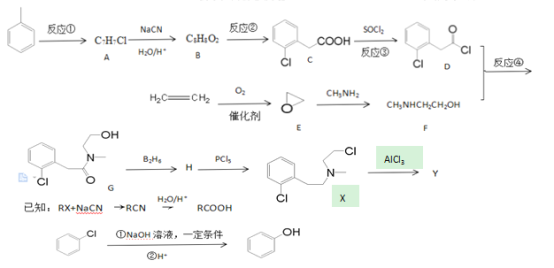
题目内容
【题目】周期表前四周期的元素X、Y、Z、T、W,原子序数依次增大。X的核外电子总数与其周期数相同,Y基态原子的p电子数比s电子数少1个,Z基态原子的价电子层中有2个未成对电子,T与Z同主族,W基态原子的M层全充满,N层只有一个电子。回答下列问题:
(1)Y、Z、T中单质熔点最高是______(填元素符号)
(2)比W原子序数少5的基态原子中单电子数为_________________。
(3)T与Z形成的化合物中,中心原子杂化类型是_______
(4)X和上述其他元素中的一种形成的化合物中:分子呈三角锥形的是________(填化学式);分子中既含有极性共价键,又含有非极性共价键的化合物是_______(填化学式,写一种)。
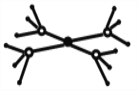
(5)这5种元素形成的一种阴阳离子个数比为1:1型的配合物中,阴离子呈四面体结构,阳离子的结构如图所示。该配合物的化学式为__________,阳离子中存在的化学键类型有_______。
【答案】 S 6 sp2 NH3 H2O2或N2H4 [Cu(NH3)4]SO4 共价键、配位键或极性共价键、配位键
【解析】周期表前四周期的元素X、Y、Z、T、W,原子序数依次增大。X的核外电子总数与其周期数相同,则X为H元素;Y基态原子的p电子数比s电子数少1个,则核外电子排布为1s22s22p3,故Y为N元素;W基态原子的M层全充满,N层只有一个电子,则其核外电子数为2+8+18+1=29,故W为Cu;T与Z同主族,Z基态原子的价电子层中有2个未成对电子,外围电子排布ns2np2或ns2np4,由于Z原子序数大于氮,T的原子序数小于Cu,外围电子排布不能为ns2np2,只能为ns2np4,故Z为O元素、T为S元素。则
(1)氮气、氧气常温下均是气态,S是固体,则单质熔点最高是S;(2)比W原子序数少5的元素是Cr,其基态原子的核外电子排布式为1s22s22p63s23p63d54s1,所以单电子数为6。(3)S与O形成的化合物有SO2、SO3,中心原子杂化类型均是sp2;(4)X和上述其他元素中的一种形成的化合物中,分子呈三角锥形的是NH3;分子中既含有极性共价键,又含有非极性共价键的化合物是H2O2或N2H4。(5)这5种元素形成的一种阴阳离子个数比为1:1型的配合物中,阳离子的结构如图所示,配体中有3个共价键、1对孤对电子,为NH3,配离子为[Cu(NH3)4]2+,阴离子带2个单位负电荷,且呈四面体结构,为SO42-,故配合物化学式为:[Cu(NH3)4]SO4,阳离子中存在的化学键类型有:共价键、配位键。