题目内容
【题目】实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图所示(铁架台、铁夹、酒精灯等未画出):
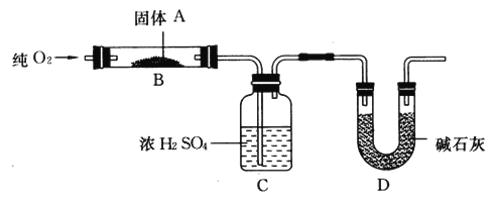
取17.1 g A放入B装置中,通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
(1)通入过量O2的目的是________。
(2)C装置的作用是________;D装置的作用是________。
(3)通过该实验,能否确定A中是否含有氧元素? ___________________。
(4)若A的摩尔质量为342 g/mol,C装置增重9.9 g,D装置增重26.4 g,则A的分子式为_____。
(5)写出A燃烧的化学方程式:__________________。
(6)A可发生水解反应,1 mol A可水解生成2 mol同分异构体,则A在催化剂作用下水解的化学方程式为________________________。
【答案】使有机物A充分燃烧 吸收A燃烧后生成的H2O 吸收A燃烧后生成的CO2 能确定 C12H22O11 C12H22O11+12O2![]() 12CO2+11H2O C12H22O11+H2O
12CO2+11H2O C12H22O11+H2O![]() C6H12O6+C6H12O6
C6H12O6+C6H12O6
【解析】
(1)有机物在氧气中燃烧生成二氧化碳和水;
(2)浓硫酸吸收水,碱石灰吸收二氧化碳;
(3)根据质量守恒计算判断;
(4)根据浓硫酸和碱石灰增重的质量可计算有机物生成的水和二氧化碳的物质的量,根据C元素、H元素守恒和O元素守恒可计算有机物中C、H、O元素的物质的量,进而计算各元素的物质的量之比,最终可计算有机物的分子式;
(5)C12H22O11在氧气中燃烧生成二氧化碳和水;
(6)A可发生水解反应,1mol A可水解生成2mol同分异构体,则A为蔗糖,蔗糖水解生成葡萄糖和果糖。
(1)燃烧法测定某固体有机物A的分子组成,要通入过量O2使有机物在氧气中充分燃烧生成二氧化碳和水;
(2)C装置中的试剂为浓硫酸,用于吸收有机物燃烧生成的水,D装置中的试剂是碱石灰用于吸收有机物燃烧生成的二氧化碳;
(3)通过浓硫酸增重的质量可以求出有机物中氢的质量,通过碱石灰增重的质量可以求出有机物中碳的质量,再根据A的质量判断是否有氧元素;
(4)浓硫酸增重可知水的质量为9.9g,可计算出n(H2O)=![]() =0.55mol,n(H)=1.1mol,m(H)= 1.1mol ×1g/mol=1.1g;使碱石灰增重26.4g,可知二氧化碳质量为26.4g,n(C)=n(CO2)=
=0.55mol,n(H)=1.1mol,m(H)= 1.1mol ×1g/mol=1.1g;使碱石灰增重26.4g,可知二氧化碳质量为26.4g,n(C)=n(CO2)=![]() =0.6mol,m(C)= 0.6mol ×12g/mol=7.2g,m(C)+m(H)=8.3g,有机物的质量为17.1g,所以有机物中氧的质量为=17.1g-8.3= 8.8g,n(O)=
=0.6mol,m(C)= 0.6mol ×12g/mol=7.2g,m(C)+m(H)=8.3g,有机物的质量为17.1g,所以有机物中氧的质量为=17.1g-8.3= 8.8g,n(O)=![]() =0.55mol,n(C):n(H):n(O)=0.6mol:1.1mol:0.55mol≈12:22:11,即实验式为C12H22O11,A的摩尔质量为342g/mol,所以分子式也为C12H22O11;
=0.55mol,n(C):n(H):n(O)=0.6mol:1.1mol:0.55mol≈12:22:11,即实验式为C12H22O11,A的摩尔质量为342g/mol,所以分子式也为C12H22O11;
(5)C12H22O11在氧气中燃烧生成二氧化碳和水,其反应的方程式为:C12H22O11+12O2![]() 12CO2+11H2O;
12CO2+11H2O;
(6)A可发生水解反应,1mol A可水解生成2mol同分异构体,则A为蔗糖,蔗糖水解生成葡萄糖和果糖,其在催化剂作用下水解的化学方程式为C12H22O11(蔗糖)+H2O![]() C6H12O6(葡萄糖)+C6H12O6(果糖)。
C6H12O6(葡萄糖)+C6H12O6(果糖)。