题目内容
【题目】碳酸氢钠是一种重要的化工原料,在日常生活中也有广泛的用途,侯德榜先生发明了连续生产纯碱与氯化铵的联合制碱工艺,成为近代化学工业的奠基人之一,该反应原理为:NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl △H<0。
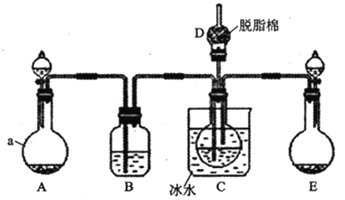
现用如图所示装置和上述原理制取碳酸氢钠晶体,图中夹持装置已略去。
可选用的药品有:①石灰石②生石灰③6mol/L盐酸④稀硫酸⑤浓氨水⑥饱和氯化钠溶液⑦饱和碳酸氢钠溶液
请回答下列问题:
(1)仪器a的名称是___。
(2)B中应选用的药品是___(填序号)
(3)在实验过程中,应先向C中通入的气体的化学式是___,其原因是___。
(4)D中脱脂棉应浸润的试剂是___(填写字母编号)。
a.浓硫酸 b.稀硫酸 c.氢氧化钠溶液 d.浓硝酸
(5)该小组同学为了测定C中所得晶体中碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),先将晶体充分干燥后,称量质量为wg,然后进行如图所示实验:

①操作Ⅲ中的方法是___,___,___。
②所得晶体中碳酸氢钠的纯度是___(不必化简)。
【答案】圆底烧瓶 ⑦ NH3 CO2在水中溶解度小,先通NH3至饱和,有利于NaHCO3析出 b 过滤 洗涤 干燥 ![]() ×100%
×100%
【解析】
(1)根据装置图判断仪器a的名称;
(2)B装置的作用为除去二氧化碳中的氯化氢;
(3) 根据![]() 在水中溶解度小、氨气极易溶于水分析;
在水中溶解度小、氨气极易溶于水分析;
(4)D中脱脂棉的作用是吸收逸出的氨气;
(5)①操作Ⅲ是沉淀与溶液分离;
![]() 装置为制取二氧化碳的装置,仪器a为圆底烧瓶;
装置为制取二氧化碳的装置,仪器a为圆底烧瓶;
![]() 装置的作用为除去二氧化碳中的氯化氢,二氧化碳在饱和碳酸氢钠溶液中溶解度不大,氯化氢能够与碳酸氢钠反应生成二氧化碳,所以B中盛有试剂为饱和碳酸氢钠溶液,选
装置的作用为除去二氧化碳中的氯化氢,二氧化碳在饱和碳酸氢钠溶液中溶解度不大,氯化氢能够与碳酸氢钠反应生成二氧化碳,所以B中盛有试剂为饱和碳酸氢钠溶液,选![]() ;
;
(3)![]() 在水中溶解度小,氨气极易溶于水,则先通
在水中溶解度小,氨气极易溶于水,则先通![]() 至饱和,然后通入二氧化碳气体,有利于
至饱和,然后通入二氧化碳气体,有利于![]() 析出;
析出;
![]() D中脱脂棉的作用是吸收逸出的氨气,浓硫酸能使棉花脱水、浓硝酸具有挥发性,氨气为碱性气体,与硫酸反应,所以选择稀硫酸,选b;
D中脱脂棉的作用是吸收逸出的氨气,浓硫酸能使棉花脱水、浓硝酸具有挥发性,氨气为碱性气体,与硫酸反应,所以选择稀硫酸,选b;
![]() ①测定C中所得晶体的碳酸氢钠的纯度,将晶体充分干燥后,称量质量为wg,此时为碳酸氢钠粗品质量,操作1将晶体加热到质量不再变化时,所得粉末为碳酸钠和杂质,然后溶解,加入氢氧化钡溶液,氢氧化钡跟碳酸钠反应生成碳酸钡,将生成的碳酸钡过滤、洗涤、干燥,称量为
①测定C中所得晶体的碳酸氢钠的纯度,将晶体充分干燥后,称量质量为wg,此时为碳酸氢钠粗品质量,操作1将晶体加热到质量不再变化时,所得粉末为碳酸钠和杂质,然后溶解,加入氢氧化钡溶液,氢氧化钡跟碳酸钠反应生成碳酸钡,将生成的碳酸钡过滤、洗涤、干燥,称量为![]() ,反应的化学方程式为
,反应的化学方程式为![]() ,
,![]() ,得到的碳酸钡需要经过过滤、洗涤、干燥后方可称量,所以操作Ⅲ中的方法是过滤、洗涤、干燥;
,得到的碳酸钡需要经过过滤、洗涤、干燥后方可称量,所以操作Ⅲ中的方法是过滤、洗涤、干燥;
②设样品中碳酸氢钠的质量为x,由上两式可得关系式:
![]()
![]() 197
197
x n
![]() ,
,![]() ,
,
所得晶体中碳酸氢钠的纯度![]() 。
。

【题目】实验室常用亚硫酸钠固体和70%的浓硫酸制备SO2气体,反应方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,请设计一套实验装置,收集一试管干燥的SO2气体。
(1)在下面方框中,A表示由分液漏斗和锥形瓶组成的气体发生器,请在答题卡上的A后完成该反应的实验装置示意图(夹持装置、连接胶管不必画出,尾气处理部分必须画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C…;其它可选用的仪器(数量不限)简易表示如下:___
(2)根据方框中的装置图甲,在答题卡上填写下表(可不填满)___
仪器标号 | 仪器中所加物质 | 作用 |
A | 亚硫酸钠、浓硫酸 | 产生SO2 |
(3)某实验小组用如图乙装置测定收集到的气体中SO2的含量,反应管中装有酸性高猛酸钾溶液。
①SO2和酸性高猛酸钾溶液发生反应的离子方程式为:___。
②反应管内溶液紫红色消失后,若没有及时停止通气,则测得的SO2含量___(选填:“偏高”、“偏低”或“无影响”)
③若酸性高猛酸钾溶液体积为V1mL,浓度为cmol/L,量气管内增加的水的体积为V2mL(已折算成标准状况下的体积)。用c、V1、V2表示SO2的体积百分含量为___。
【题目】第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物,单质铁、砷及它们的化合物广泛应用于超导体材料等领域,请回答下列问题:
(1)Fe2+的核外电子排布式为_________________。
(2)NH3是一种很好的配体,NH3的沸点______(填“>”“=”或“<”)AsH3。
(3)N原子核外有______种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为___________。
(4)科学家通过X射线测得胆矾结构示意图可简单表示如图,图中虚线表示的作用力为________________。

(5)As的卤化物的熔点如下:
AsCl3 | AsBr3 | AsI3 | |
熔点/K | 256.8 | 304 | 413 |
表中卤化物熔点差异的原因是________________。
(6)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图所示,图中M代表Fe3+,则Fe3+与氮原子之间形成的化学键是_________,Fe3+的配位数为_________。

(7)FeS2晶体的晶胞如图所示。晶胞边长为anm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_________g·cm-3;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为_________nm。