题目内容
【题目】甲醇(CH3OH)是重要的溶剂和替代燃料,工业常以CO和H2的混合气体为原料一定条件下制备甲醇。
(1)甲醇与乙醇互为 ;完全燃烧时,甲醇与同物质的量的汽油(设平均组成为C8H18)消耗O2量之比为 。
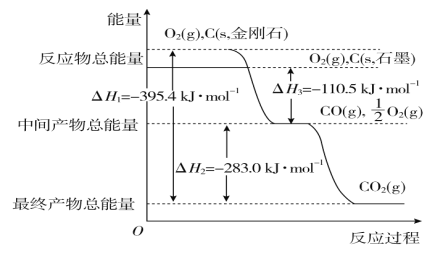
(2)工业上常用“水煤气法”获得CO和H2,其反应原理如下:
C(s) + H2O(g) ![]() CO(g) + H2(g) CO(g) + H2O(g)
CO(g) + H2(g) CO(g) + H2O(g) ![]() CO2(g) + H2(g)
CO2(g) + H2(g)
某水煤气样品中含0.2LCO、0.5LCO2,则该样品中含H2 L。
(3)工业上还可以通过下列途径获得H2,其中节能效果最好的是 。
A. 高温分解水制取H2:2H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
B. 电解水制取H2:2H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
C. 甲烷与水反应制取H2:CH4 + H2O![]() 3H2 + CO
3H2 + CO
D. 在光催化剂作用下,利用太阳能分解水制取H2:2H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
(4)在2L的密闭容器中充入1molCO和2molH2,一定条件下发生反应:CO(g)+2H2(g) ![]() CH3OH(g) 测得CO和CH3OH(g)浓度变化如图所示。
CH3OH(g) 测得CO和CH3OH(g)浓度变化如图所示。

① 从反应开始到平衡,氢气的平均反应速率v(H2)= mol·(L·min)—1。
② 能够判断该反应达到平衡的是 (填选项)。
A.CO、H2和CH3OH三种物质的浓度相等
B.密闭容器中混合气体的密度不再改变
C.CH3OH分解的速率和CH3OH生成的速率相等
D.相同时间内消耗1 mol CO,同时消耗1 mol CH3OH
(5)为使合成甲醇原料的原子利用率达100%,实际生产中制备水煤气时还使用CH4,则生产投料时,n(C)∶n(H2O)∶n(CH4)= 。
【答案】(1)同系物; 3∶25 (或0.12)
(2)1.2
(3)D
(4)① 0.125 ② CD
(5)1∶2∶1 (每空2分)
【解析】
试题分析:(1)甲醇和乙醇结构相似,在分子组成上相差一个CH2,是同系物;等物质的量甲醇和C8H18燃烧消耗氧气的物质的量比为(1+4/4-1/2):(8+18/4)= 3∶25 ;(2)生成0.5L二氧化碳的同时生成0.5L氢气,消耗0.5L的一氧化碳,则第一个反应生成的一氧化碳为0.5+0.2=0.7L,则同时产生的氢气为0.7L,总共氢气的体积为0.5+0.7=1.2L;(3)途径中只有D不消耗能量,所以节能效果最好;(4)①甲醇的生成量为0.75mol,则氢气的消耗量为1.5mol,则氢气表示的反应速率为15/2/3= 0.125 mol·(L·min)—1;② A、三种物质的浓度相等,不能说明到平衡,错误;B、反应前后气体总质量不变,容器的体积不变,则密度始终不变,故错误;C、甲醇的分解速率和甲醇的生成速率相等,说明正逆反应速率相等,则说明到平衡;D、说明正逆反应速率相等,故正确,故选CD;(5)根据原子利用率100%的要求,反应为C+2H2O+CH4=2CH4O,即三者的物质的量比为1∶2∶1。