题目内容
【题目】能源危机当前是一个全球性问题,开源节流是应对能源危机的重要举措。
(1)下列做法有助于“开源节流”的是________(填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气,以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,注重资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。
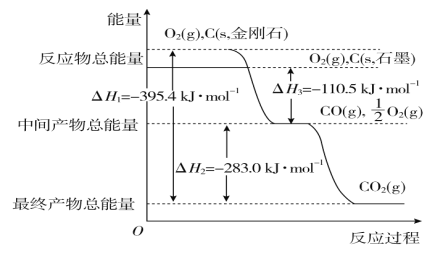
①在通常状况下,金刚石和石墨相比较,________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为________。
②12 g石墨在一定量的空气中燃烧,生成气体36 g,该过程放出的热量为________。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。
N2(g)+O2(g)===2NO(g) ΔH=+180.0 kJ· mol-1NO分子中化学键的键能为____kJ·mol-1。
(4)综合上述有关信息,请写出用CO除去NO的热化学方程式:______________________。
【答案】(1) acd
(2)①石墨;393.5 kJ·mol-1
②252.0 kJ
(2)631.5
(3)2NO(g)+2CO(g)=N2(g)+2CO2(g)ΔH=-746.0 kJ·mol-1
【解析】
试题分析:(1)只要能减少化石燃料等资源的运用都属于“开源节流”; a、c、d均能减少化石燃料的运用,故正确;b.大力开采煤、石油和天然气,不能减少化石燃料的运用,故错误。
故答案为:acd;
(2)①图象分析金刚石能量高于石墨,能量越低越稳定,所以说明石墨稳定,图象分析1mol石墨完全
燃烧生成1mol二氧化碳放出的热量为393.5kJ,则石墨的燃烧热为393.5kJmol-1。
故答案为:石墨;393.5kJmol-1;
②12g石墨物质的量为1mol,在一定量空气中燃烧,依据元素守恒,若生成二氧化碳质量为44g,若生成一氧化碳质量为28g,生成气体36g,28g<36g<44g,判断生成的气体为一氧化碳和二氧化碳气体,设一氧化碳物质的量为x,二氧化碳物质的量为(1-x)mol,28x+44(1-x)=36g,x=0.5mol,二氧化碳物质的量为0.5mol;依据图象分析,C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJmol-1 ;C(石墨,s)+1/2O2(g)═CO(g)△H=-110.5 kJmol-1
生成二氧化碳和一氧化碳混合气体放出热量=393.5 kJmol-1 ×0.5mol+110.5 kJmol-1 ×0.5mol=252KJ;12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为252.0kJ。
故答案为:252.0 kJ;
(3)根据N2、O2分子中化学键的键能分别是946kJmol-1、497kJmol-1以及反应N2(g)+O2(g)=2NO(g)△H=+180kJmol-1可设NO分子中化学键的键能为X,则有:946kJmol-1+497kJmol-1-2X=180kJmol-1 得:X=631.5kJmol-1。
故答案为:631.5;
(4)已知①C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJmol-1 ;
②C(石墨,s)+1/2O2(g)═CO(g)△H=-110.5 kJmol-1;
③N2(g)+O2(g)=2NO(g)△H=+180kJmol-1;
由盖斯定律:方程式①×2-②×2-③得2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746.0kJ·mol-1。
故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746.0 kJ·mol-1。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案