题目内容
【题目】在恒温条件下,将一定量![]() 和
和![]() 的混合气体通入一容积为2L的密闭容器中,测得各物质的浓度随时间变化关系如图所示.下列说法正确的是
的混合气体通入一容积为2L的密闭容器中,测得各物质的浓度随时间变化关系如图所示.下列说法正确的是![]()
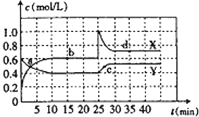
A.图中的两条曲线中,Y是表示![]() 浓度随时间的变化曲线
浓度随时间的变化曲线
B.前10min内,用![]() 表示的化学反应速率为
表示的化学反应速率为![]()
C.在25min时,反应改变的条件是增大了![]() 的浓度
的浓度
D.a、b、c、d四个点中,有a、b、d点的化学反应处于平衡状态
【答案】C
【解析】
A.由图可知![]() 平衡状态时,X表示的生成物的浓度变化量为
平衡状态时,X表示的生成物的浓度变化量为![]() ,Y表示的反应物的浓度变化量为
,Y表示的反应物的浓度变化量为![]() ,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示
,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示![]() 浓度随时间的变化曲线,Y表示
浓度随时间的变化曲线,Y表示![]() 浓度随时间的变化曲线,故A错误;
浓度随时间的变化曲线,故A错误;
B.X表示![]() 浓度随时间的变化曲线,Y表示
浓度随时间的变化曲线,Y表示![]() 浓度随时间的变化曲线,由图可知,前10min内,
浓度随时间的变化曲线,由图可知,前10min内,![]() 的浓度变化量为
的浓度变化量为![]() ,所以
,所以![]() ,故B错误;
,故B错误;
C.25min时,生成物浓度增大,反应物浓度不变,只能是增大生成物的浓度,由A分析可知![]() 是生成物,故为增大
是生成物,故为增大![]() 的浓度,故C正确;
的浓度,故C正确;
D.由图可知,![]() 及35min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,即b、d处于化学平衡状态,故D错误;
及35min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,即b、d处于化学平衡状态,故D错误;
答案选C。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案【题目】某温度下, 反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数
H2O(g)+CO(g)的平衡常数![]() 。该温度下在体积均为10 L的三个密闭容器中分别加入反应物,起始加入量如图所示:下列判断不正确的是
。该温度下在体积均为10 L的三个密闭容器中分别加入反应物,起始加入量如图所示:下列判断不正确的是
起始量 | 甲 | 乙 | 丙 |
H2 (mol) | 1 | 2 | 2 |
CO2(mol) | 1 | 1 | 2 |
A.反应开始时,甲中的反应速率最慢,丙中的反应速率最快
B.平衡时,甲和丙中CO2的转化率相等,均是60%
C.平衡时,乙中H2的转化率大于60%
D.平衡时,丙中c(H2 ) 是0. 08 mol·L-1
【题目】下述实验不能达到预期目的的是
编号 | 实验内容 | 实验目的 |
A | 将SO2通入酸性KMnO4溶液中 | 证明SO2具有还原性 |
B | 将Cl2通入NaBr溶液中 | 比较氯与溴的氧化性强弱 |
C | 将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 | 研究温度对化学平衡的影响 |
D | 分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量MnO2 | 研究催化剂对H2O2分解速率的影响 |
A. A B. B C. C D. D
【题目】已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
① 称量1.000 g样品溶于水,配成250 mL溶液;
② 准确量取25.00 mL所配溶液于锥形瓶中;
③ 滴加几滴酚酞溶液;
④ 用0.1000 mol/L 的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
滴定前读数 | 滴定后读数 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 1.10 | 21.00 |
请回答:
(1)用_______滴定管(填“酸式”或“碱式”)盛装0.1000 mol/L的盐酸标准液。
(2)判断滴定终点到达时的现象_________。
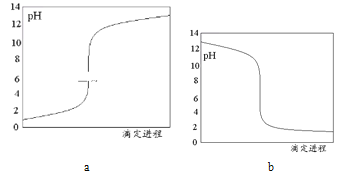
(3)该滴定过程的滴定曲线是下列的______(选填“a”、“b”)。
(4)若出现下列情况,测定结果偏高的是__________。
a 滴定前用蒸馏水冲洗锥形瓶
b 在振荡锥形瓶时不慎将瓶内溶液溅出
c 若在滴定过程中不慎将数滴酸液滴在锥形瓶外
(5)通过计算可知该烧碱样品的纯度为______________。