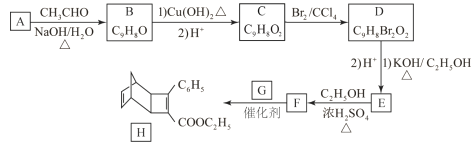
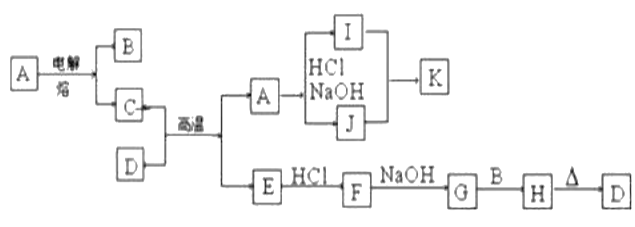
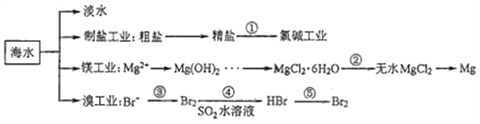
题目内容
【题目】向NaOH和Na2CO3混合溶液中滴加0.1molL-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图 所示。下列判断正确的是
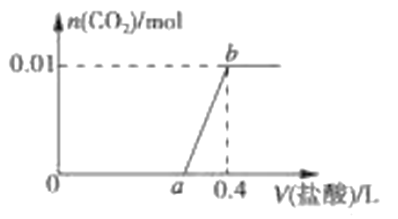
A. 在0a范围内,只发生NaOH和HCl的反应
B. ab段发生反应的离子方程式为:CO32-+2H+=CO2↑+H2O
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
【答案】C
【解析】
向氢氧化钠和碳酸钠混合溶液中滴加稀盐酸,盐酸会先与氢氧化钠反应,再与碳酸钠反应。盐酸与碳酸钠反应分为两步,首先盐酸与碳酸钠反应生成碳酸氢钠和氯化钠,然后盐酸与碳酸氢钠反应生成二氧化碳、氯化钠和水,据此解答。
反应方程式依次如下:
①HCl+NaOH=NaCl+H2O;
②HCl+Na2CO3=NaHCO3+NaCl;
③HCl+NaHCO3=NaCl+CO2↑+H2O。
A. a点以后开始生产二氧化碳气体,则0~a范围内发生的化学反应为①和②,不仅仅是酸碱中和反应,故A项错误;
B. ab段为生成二氧化碳的过程,发生反应的化学方程式为③,故其离子方程式为HCO3-+H+=CO2↑+H2O,故B项错误;
C. 由图可知生成二氧化碳0.01 mol,根据碳元素守恒,则混合物中碳酸钠的物质的量是0.01 mol,所以两步反应②、③消耗的盐酸的量均是0.01 mol,则稀盐酸的体积均是0.01mol÷0.1mol/L=0.1 L,故a=0.4-0.1=0.3,故C项正确;
D. 根据碳元素守恒可知,混合物中Na2CO3的物质的量等于生成的CO2的物质的量,为0.01 mol,因0~a(0~0.3)阶段消耗的盐酸的总的物质的量为0.3 L×0.1mol/L=0.03 mol,发生反应②碳酸钠消耗的盐酸的物质的量为0.01 mol,则反应①中氢氧化钠消耗的盐酸为0.03 mol-0.01 mol=0.02 mol,即氢氧化钠的物质的量为0.02 mol,从而可得原混合溶液中NaOH和Na2CO3的物质的量之比为2:1,故D项错误;
答案选C。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案