题目内容
17.在一定条件下发生反应3A(g)+2B(g)?zC(g)+2D(g),在2L的密闭容器中把4mol A和2mol B混合,2min后反应达到平衡时生成1.6mol C,又测得反应速率v(D)=0.2mol•L-1•min-1.则下列说法不正确的是( )| A. | z=4 | B. | B的转化率是40% | ||
| C. | A的平衡浓度是1.4 mol•L-1 | D. | 平衡时气体压强是原来的1.2倍 |
分析 根据反应速率之比等于化学计量数之比来确定化学计量数z,VD=0.2mol/(L•min),VC=$\frac{\frac{1.6mol}{2L}}{2min}$=0.4mol/(L•min),则z=4;
3A(g)+2B(g)?4C(g)+2D(g),
开始 4 2 0 0
转化1.2 0.8 1.6 0.8
平衡2.8 1.2 1.6 0.8
结合转化率的概念及物质的量之比等于压强之比来计算.
解答 解:根据反应速率之比等于化学计量数之比来确定化学计量数z,VD=0.2mol/(L•min),VC=$\frac{\frac{1.6mol}{2L}}{2min}$=0.4mol/(L•min),则z=4;
3A(g)+2B(g)?4C(g)+2D(g),
开始 4 2 0 0
转化1.2 0.8 1.6 0.8
平衡2.8 1.2 1.6 0.8
A、计算可知z=4,故A正确;
B、B的转化率=$\frac{0.8mol}{2mol}$×100%=40%,故B正确;
C、A的平衡浓度=$\frac{2.8mol}{2L}$=1.4mol/L,故C正确;
D、气体物质的量之比等于压强之比,平衡时气体压强是原来的$\frac{2.8mol+1.2mol+1.6mol+0.8mol}{4mol+2mol}$=$\frac{16}{15}$,故D错误;
故选D.
点评 本题考查化学平衡的计算,为高频考点,侧重于学生的分析、计算能力的考查,熟悉化学平衡的三段法计算及转化率的计算即可解答,注意反应速率与化学计量数的关系、化学计量数与压强的关系来解答,题目难度中等.

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案| A. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| B. | 正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 | |
| C. | 正、逆反应速率都增大,平衡向正反应方向移动 | |
| D. | 正、逆反应速率都没有变化,平衡不发生移动 |
| A. | O3和CO2 | B. | OH-和Al3+ | C. | NO和CO | D. | Cl-和Ne |
Ⅰ脱硝:已知:H2的热值为142.9KJ•g-1
N2(g)+2O2(g)=2NO2(g)△H=+133kJ•mol-1
H2O(g)=H2O(l)△H=-44kJ•mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
Ⅱ脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在恒温恒容的条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
(1)该反应v-t图象如图甲所示;若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.现有下列叙述:
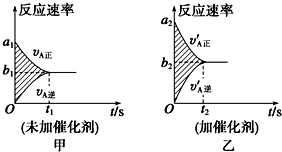
①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2.
则以上所述各项正确的组合为B
A.②④⑥B.②④⑤C.②③⑤D.②③⑥
(2)下列叙述能说明此反应达到平衡状态的是abe.
a、混合气体的平均相对分子质量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
(3)该反应过程中部分数据见表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 0 min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | |||
| 20min | 1 | |||
| 30min | 1 |
②前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1,平衡时H2的浓度c(H2)=1.5mol•L-1,平衡时CO2的转化率=50%
③在其它条件不变下,若20min时往密闭容器中通入1mol氖气,此时该反应速率将不变(填“变大”、“变小”或“不变”,下同);若20min时往密闭容器中通入1mol氢气,此时该反应速率将变大.
| A. | 0.3 mol•L-1 | B. | 0.4 mol•L-1 | C. | 0.45 mol•L-1 | D. | 0.5 mol•L-1 |
| A. | C5H12 | |
| B. | C3H7Cl | |
| C. | C5H10O2酯类的同分异构体 | |
| D. | 含有一个碳碳双键的分子式为C3H4Cl2的同分异构体 |
| A. | 氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 | |
| B. | 铵盐受热易分解 | |
| C. | 0.1 mol/L氨水可以使酚酞试液变红 | |
| D. | 常温下,0.1 mol/L氨水的pH约为9 |
| A. | 在含有大量I-离子的溶液中:Cl?、Fe3+、Al3+、Cu2+ | |
| B. | 滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、NO3-能够大量共存 | |
| C. | pH=13的溶液:S2-、SO32-、SO42-、Na+ | |
| D. | 在加入Al能放出大量H2的溶液中:NH4+、SO42?、C1?、HCO3? |