题目内容
【题目】下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:

(1)③⑤⑥⑦中原子半径最大的是 (用元素符号表示,下同),②③④⑤的简单离子中半径最小的是 。
(2) ③⑤中元素的金属性强弱顺序为 ,⑥⑦元素的非金属性强弱顺序为
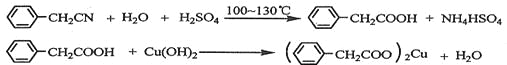
(3)①、②两种元素按原子个数比为1∶1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 。
(4)碳酸钠溶液呈碱性的原因 。(用离子方程式表示)
【答案】(1)Na; Al3+
(2)Na> Al 、Cl> S
(3)H2O2+2Fe2++2H+===2Fe3++2H2O
(4)CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
【解析】试题分析:根据元素周期表的结构可知,①至⑦元素分别为H、O、Al、F、Na、S、Cl。
(1)同周期元素从左到右原子半径逐渐减小,③⑤⑥⑦属于同周期元素,则原子半径最大的是Na;具有相同电子层结构的离子,质子数越多,离子半径越小,②③④⑤的简单离子具有相同的电子层结构,则离子半径最小的是Al3+。
(2)同周期元素,从左到右,元素的金属性逐渐减弱,非金属性逐渐增强,则③⑤中元素的金属性强弱顺序为Na>Al,⑥⑦元素的非金属性强弱顺序为Cl>S。
(3)①、②分别为H、O,H、O两种元素按原子个数比为1∶1组成的常见液态化合物为H2O2,H2O2在酸性溶液中能将Fe2+氧化成Fe3+,而自身得电子生成水,然后根据得失电子守恒、电荷守恒、原子守恒配平,反应的离子方程式为H2O2+2Fe2++2H+===2Fe3++2H2O。
(4)碳酸钠是强碱弱酸盐,碳酸根离子水解导致溶液显碱性,则碳酸钠溶液呈碱性的原因CO32-+H2O![]() HCO3-+OH-。
HCO3-+OH-。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】(13分)乙酸正丁酯是一种水果香味的无色透明液体,常用于调制香料和药物。实验室用正丁醇和乙酸制备,反应原理如下:
CH3COOH+CH3CH2CH2CH2OH![]() CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
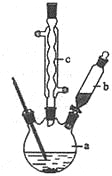
某兴趣小组拟用如图装置制备少量乙酸正丁酯:

步骤1:加料。向干燥的100ml圆底烧瓶中加入37ml正丁醇、22ml冰醋酸及10滴浓硫酸(试剂加入顺序未确定),摇匀后,加入几粒沸石。然后安装分水器(先在分水器上端小心加水至分水器支管口处,然后再放出1~2ml的水)及回流冷凝管。
步骤2:加热回流。通过活塞控制分水器中水层液面的高度。反应完毕,停止加热。
步骤3:冷却(不可以拆卸回流冷凝管)。冷却至室温后,将烧瓶中的混合物与分水器中的酯层合并,转入分液漏斗中。
步骤4:依次用10ml水,10ml 10%碳酸钠溶液洗至中性(pH=7),再水洗一次,向洗涤后的有机相中加入适量的无水硫酸镁固体。放置一段时间后过滤、蒸馏、收集124~126℃馏分,得产品)
步骤5:用一干燥的小烧杯称产品,重量为29.0g。
相关物质的性质如下表:
物质名称 | 沸点/℃ | 熔点/℃ | 密度/g·cm-3 | 水中溶解度 |
正丁醇 | 117.3 | -89.5 | 0.80 | 7.1g/100g |
乙酸 | 118 | 16.6 | 1.0492 | 互溶 |
乙酸正丁酯 | 126.1 | -78 | 0.8826 | 1.4g/100g |
根据题意完成下列填空:
(1)加料时,三种试剂的加入顺序为 。
(2)该实验中,冷凝水从 (填“a”或“b”)口通入,使用分水器的目的是 。
(3)步骤2中判断反应结束的现象是 。
(4)步骤3中从分液漏斗中得到酯的操作 ,用10% Na2CO3溶液洗涤有机相,是为了除去有机相中的 (填结构简式)。
(5)步骤4中加入无水硫酸镁固体的作用是 。
(6)实验中正丁醇的转化率为 。