题目内容
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:
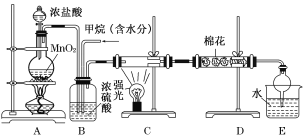
试回答下列问题:
(1)请写出C装置中生成CH3Cl的化学反应方程式:______________________________。
有人认为E中有氯化氢产生,不能证明甲烷与氯气发生了取代反应,你认为他的看法________(填“正确”或 “不正确”)。
(2)B装置有三种功能;①控制气流速度;②混匀混合气体;③________。
(3)一段时间后发现D装置中的棉花由白色变为蓝色,则棉花上可能预先滴有________溶液。
(4)E装置中除盐酸外,还含有机物,从E中分离出盐酸的最佳方法为________(填字母)。
A.分液法 B.蒸馏法 C.结晶法
(5)将1molCH4与Cl2发生取代反应,充分反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1mol,则参加反应的Cl2的物质的量为 ,生成HCl的物质的量共为 。
【答案】(1) CH4+Cl2 ![]() CH3Cl+HCl,正确;(2)干燥气体;(3) KI-淀粉;(4)A;(5)3mol,3mol。
CH3Cl+HCl,正确;(2)干燥气体;(3) KI-淀粉;(4)A;(5)3mol,3mol。
【解析】
试题分析:(1)甲烷和氯气发生取代反应,生成一氯代烷的方程式为:CH4+Cl2 ![]() CH3Cl+HCl,有可能是氯气和水反应产生HCl,故此同学说法正确;(2)盛放的是浓硫酸,利用浓硫酸的吸水性,作干燥剂,即干燥Cl2;(3)蓝色一般可能是无水硫酸铜与水变蓝,也可能是淀粉与碘单质变蓝,根据装置图,只能是淀粉遇碘变蓝,因此棉花上淀粉-KI溶液,利用氯气把碘置换出来;(4)有机物为卤代物,不溶于水,可以采用分液的方法进行分离,故选项A正确;(5)设CH3Cl为xmol,则CH2Cl2为x+0.1,CHCl3为x+0.2,CCl4为x+0.3,根据碳原子守恒,x+x+0.1+x+0.2+x+0.3=1,解得x=0.1,因此消耗氯气的物质的量为(0.1+0.2×2+0.3×3+0.4×4)mol=3mol,消耗氯气的物质的量等于生成HCl物质的量,即3mol。
CH3Cl+HCl,有可能是氯气和水反应产生HCl,故此同学说法正确;(2)盛放的是浓硫酸,利用浓硫酸的吸水性,作干燥剂,即干燥Cl2;(3)蓝色一般可能是无水硫酸铜与水变蓝,也可能是淀粉与碘单质变蓝,根据装置图,只能是淀粉遇碘变蓝,因此棉花上淀粉-KI溶液,利用氯气把碘置换出来;(4)有机物为卤代物,不溶于水,可以采用分液的方法进行分离,故选项A正确;(5)设CH3Cl为xmol,则CH2Cl2为x+0.1,CHCl3为x+0.2,CCl4为x+0.3,根据碳原子守恒,x+x+0.1+x+0.2+x+0.3=1,解得x=0.1,因此消耗氯气的物质的量为(0.1+0.2×2+0.3×3+0.4×4)mol=3mol,消耗氯气的物质的量等于生成HCl物质的量,即3mol。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案【题目】(12分)1000ml某待测溶液中除含有0.2mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
现进行如下实验操作(每次实验所加试剂均过量):

(1)写出生成白色沉淀B的离子方程式: 。
(2)待测液中肯定不存在的阳离子是 。
(3)若无色气体D是单一气体:判断原溶液中K+是否存在 (填是或否),若存在,求其物质的量浓度的最小值,若不存在,请说明理由: 。
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是 。
②沉淀A中能与稀硝酸反应的成分是 (写化学式)。