题目内容
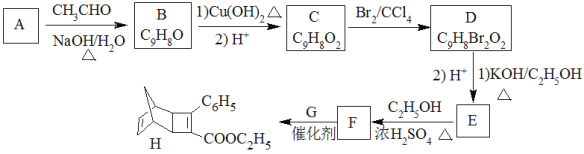
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
已知:
![]()
![]()
回答下列问题:
(1)A的化学名称为_____________________。
(2)由C生成D和E生成F的反应类型分别为__________、_________。
(3)E的结构简式为________________________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为________________________。
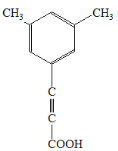
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1,写出1种符合要求的X的结构简式_____________________________。
(6)写出用环戊烷和2-丁炔为原料制备化合物 的合成路线_______(其他试剂任选)。
的合成路线_______(其他试剂任选)。
【答案】苯甲醛加成反应取代反应(或酯化反应)

 、
、 、
、 、
、 (任写1种)
(任写1种)
【解析】
A![]() B 发生题给信息
B 发生题给信息![]() 反应,B中含有9个碳原子,则A中含有7个碳原子且有一个-CHO,因此A为苯甲醛,B为
反应,B中含有9个碳原子,则A中含有7个碳原子且有一个-CHO,因此A为苯甲醛,B为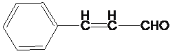 ,C为
,C为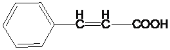 ,D为
,D为 。由F与G发生题给的成环反应,E中有碳碳三键,E为
。由F与G发生题给的成环反应,E中有碳碳三键,E为 ,E与乙醇发生酯化反应,因此F为
,E与乙醇发生酯化反应,因此F为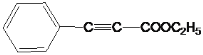 , G为
, G为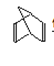 。
。
(1)根据上述分析可知,A为苯甲醛;
(2)C为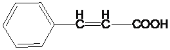 ,分子中含有碳碳双键,可以与溴单质发生加成反应;E为
,分子中含有碳碳双键,可以与溴单质发生加成反应;E为 ,分子中含有羧基,与乙醇可以发生酯化反应(取代反应);
,分子中含有羧基,与乙醇可以发生酯化反应(取代反应);
(3)F与G发生题给的成环反应,E中有碳碳三键,E为 ;
;
(4)G为甲苯的同分异构体,且F与G发生题干给信息二,因此反应方程式为: ;
;
(5)X中含有苯环,X能与饱和碳酸氢钠溶液反应放出CO2,说明X含有-COOH,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1,说明不同化学环境的氢个数之比为6∶2∶1∶1,因此X可能为; 、
、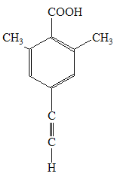 、
、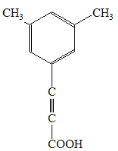 、
、 (任写1种);
(任写1种);
(6)要将两种物质组合在一起,由题给信息可知, 一种含有碳碳三键(2-丁炔),另一种含有碳碳双键。环戊烷先与氯气取代生成一氯环戊烷,再在氢氧化钠醇溶液、加热条件下消去,生成环戊烯,再与2-丁炔反应,最后与溴加成。具体流程如下 。
。

【题目】下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃)。
电解质 | 电离方程式 | 电离常数K或Ksp |
CH3COOH | CH3COO | 1.76×10-5 |
H2CO3 | H2CO3 HCO3- | K1=4.31×10-7 K2=5.61×10-11 |
C6H5OH | C6H5OH | 1.1×10-10 |
H3PO4 | H3PO4 H2PO4- HPO42- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
NH3·H2O | NH3·H2O | 1.76×10-5 |
BaSO4 | BaSO4(s) | 1.07×10-10 |
BaCO3 | BaCO3(s) | 2.58×10-9 |
回答下列问题:
(1)由上表分析,若①CH3COOH,②HCO3-,③C6H5OH,④H2PO4-均可看做酸,则它们酸性由强到弱的顺序为_____________(填编号)。
(2)写出C6H5OH与Na3PO4反应的离子方程式_______________________________。
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)____c(NH4+)(填“>”、“=”或“<”)。
(4)25℃时,向10mL0.01mol/L苯酚溶液中滴加VmL0.01mol/L氨水,混合液中粒子浓度关系正确的是__________(填字母序号)。
A.若混合液pH>7,则V≥10
B.若混合液 pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度小于10mL0.01mol/L苯酚溶液中水的电离程度
D.V= 5时,2c(NH3·H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH)
(5)水解反应是典型的可逆反应,水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式:____________。
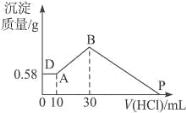
(6)I,如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:

①T1______T2(填“>”、“=”或‘‘<”),T2温度时 Ksp(BaSO4)=_______________;
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是______(填字母序号)。
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a,b之间的某一点(不含a,b)
D.升温可使溶液由b点变为d点
II.现有0.2mol的BaSO4沉淀,每次用1L饱和Na2CO3溶液(浓度为1.7mol/L)处理。若使BaSO4中的SO42-全部转化到溶液中,需要反复处理_____次。[提示:BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq)]
BaCO3(s)+SO42-(aq)]