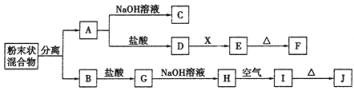
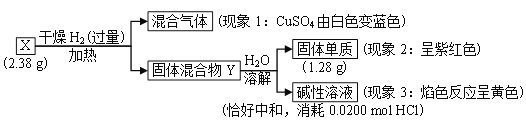
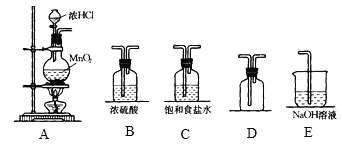
题目内容
【题目】(1)等物质的量的氧气(O2)和臭氧(O3),所含的分子数之比为___,所含的氧原子数之比为___,其相对分子量之比为___,其质量之比为___;若O2和 O3质量相等,则其分子数之比为___,氧原子数之比___。
(2)一定条件下,硝酸铵受热分解的化学方程式为:5NH4NO3═2HNO3+4N2↑+9H2O,用双线桥标出电子转移情况___。5NH4NO3═2HNO3+4N2↑+9H2O,在该反应中是氧化产物___,被氧化与被还原的N原子个数之比为___。
【答案】1:1 2:3 2:3 2:3 3:2 1:1 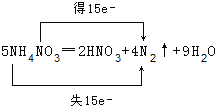 N2 5:3
N2 5:3
【解析】
(1)由N=nNA可知,分子数目之比等于其物质的量之比;氧气含有原子数目为氧气分子的2倍,臭氧分子含有氧原子数目为臭氧分子的3倍;由于氧原子质量相等,二者质量之比等于含有氧原子数目之比;O2和O3都由相同氧原子构成,二者质量相等,则含有氧原子数相等,同温同压其密度之比相对分子质量之比,以此解答该题;
(2)在5NH4NO3═2HNO3+4N2↑+9H2O的反应中,氮元素由铵根中-3价升高为0价,被氧化;氮元素由硝酸根中+5价降低为0价,被还原,氮气既是还原产物也是氧化产物,根据电子转移守恒,判断反应中氧化产物与还原产物的物质的量之比。
(1)由N=nNA可知,等物质的量的O2和O3所含分子数之比等于其物质的量,即所含的分子数之比为1:1;
氧气含有原子数目为氧气分子的2倍,臭氧分子含有氧原子数目为臭氧分子的3倍,故二者含有氧原子数目之比=2:3;
相对分子质量之比为32:48=2:3;
由于氧原子质量相等,二者质量之比等于含有氧原子数目之比,即二者质量之比为2:3;
O2和O3都由相同氧原子构成,二者质量相等,则含有氧原子数相等,即含有氧原子数目之比为1:1,分子数之比为3:2;
(2)5NH4NO3═2HNO3+4N2↑+9H2O中,铵根离子中N元素化合价由-3价升高为氮气中的0价,共失去15个电子,被还原的氮元素由硝酸根中+5价降低为氮气中的0价,共获得15个电子,用双线桥表示该反应电子转移的方向和数目为: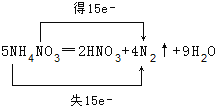 ;
;
铵根离子中N元素化合价由-3价升高为氮气中的0价,生成N2,N2为氧化产物;
根据电子转移守恒,可知氧化产物与还原产物的物质的量之比为(5-0):[0-(-3)]=5:3。被氧化与被还原的N原子个数之比为5:3。