题目内容
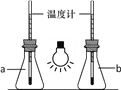
【题目】A,B两相同容器内均进行如下反应:CO(g)+H2O (g)CO2 (g)+H2(g)△H=﹣43kJmol﹣1 下列说法正确的是( ) 
A.由图象可知,B容器内反应速率较快
B.前2min内,v(CO)=0.15mol/(Lmin)
C.若容器的体积为10L,则3min内,B容器中反应放出热量43kJ
D.将A,B容器体积均压缩至原来的一半,则两容器内平衡均向右移动
【答案】C
【解析】解:A.由图可知,A先达到平衡,时间少则反应速率快,故A错误;
B.前2min内,CO的浓度变化为0.25mol/L﹣0.15mol/L=0.1mol/L,所以v(CO)= ![]() =0.05mol/L.min,故B错误;
=0.05mol/L.min,故B错误;
C.3min内,B容器中反应的CO的物质的量为(0.2mol/L﹣0.1mol/L)×10L=1mol,由CO(g)+H2O (g)CO2 (g)+H2(g)△H=﹣43kJmol﹣1可知,该反应放出热量43kJ,故C正确;
D.将A、B容器体积均压缩至原来的一半,相当于压强增大,压强对该平衡移动无影响,故D错误;
故选C.
【考点精析】本题主要考查了化学平衡状态本质及特征和化学平衡的计算的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.

 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A= , C= , E=
实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
① | 常温 | 1 | 20 | 50 | 30 | t1 |
② | 常温 | A | B | C | 30 | t2 |
③ | 常温 | 2 | 40 | D | E | t3 |
(2)该反应的离子方程式 .
(3)若t1<t2 , 则根据实验①和②得到的结论是 .
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是: 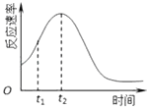
①;②
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O42H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:;实验中所需的定量仪器有(填仪器名称).该KMnO4溶液的物质的量浓度为mol/L.