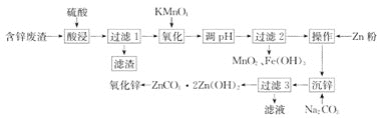
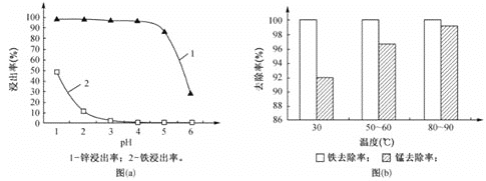
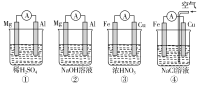
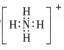题目内容
【题目】某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。
(1)实验中应选用___作指示剂。
(2)用标准的NaOH溶液滴定待测的白醋时,如何判断滴定终点:___。
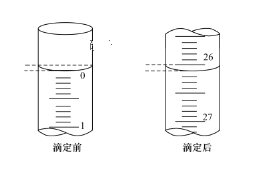
(3)第一次滴定前后,碱式滴定管中的液面位置如图所示,则V标=__mL。
(4)下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤。
正确的操作顺序是____
A.⑤④③②①⑥ B.⑤①②⑥④③
C.③⑥①②⑤④ D.③⑥①②④⑤
(5)滴定过程中进行如下操作,分别指出该项操作对滴定结果的影响(填“偏高”、“偏低”或“无影响”)
Ⅰ.滴定前未用标准液润洗碱式滴定管___;
Ⅱ.滴定结束时俯视滴定管刻度___。
【答案】酚酞 当滴入最后一滴NaOH溶液,溶液颜色由无色变为浅红色(或红色),半分钟内不褪色 26.10 C 偏高 偏低
【解析】
(1)根据恰好完全反应生成盐的酸碱性选择指示剂;
(2)根据锥形瓶内溶液颜色的变化情况判断终点;
(3)根据V标=V末-V初,注意读数要精确到0.01mL;
(4)根据中和滴定的操作步骤分析;
(5)根据操作不当对实验结果的影响。
(1)该实验滴定终点生成醋酸钠,醋酸钠水解使溶液呈碱性,应选用酚酞作指示剂,故答案为:酚酞;
(2)当达到终点时,醋酸完全反应,溶液显弱碱性,溶液颜色由无色变为浅红色(或红色),则滴定至终点的判断方法为:当滴入最后一滴NaOH溶液,溶液颜色由无色变为浅红色(或红色),半分钟内不褪色;
(3)第一次滴定前刻度为0.00mL,滴定后刻度为26.10mL,消耗溶液的体积为26.10mL;
(4)中和滴定按照检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等顺序操作,正确顺序应该为③⑥①②⑤④,C项正确,故答案为:C;
(5)Ⅰ.碱式滴定管用蒸馏水洗净后未用标准溶液润洗,则标准液会被残留的水稀释,滴定时所用标准液体积偏大,测定结果偏高,故答案为:偏高;
Ⅱ.滴定后观察碱式滴定管读数时,俯视刻度线,读数偏小,测定结果偏低,故答案为:偏低。

【题目】下图中的每一方格表示有关的一种反应物或生成物,其中甲、乙、丙、丁为常见单质,其余均为化合物。A是一种常见的液态化合物,B是具有磁性的氧化物,D和丁既能和酸反应又能和碱反应,乙在丙中燃烧产生苍白色火焰,H在空气中很容易被氧化为I2。它们的转化关系如下:(有些反应的条件和部分产物为注明)
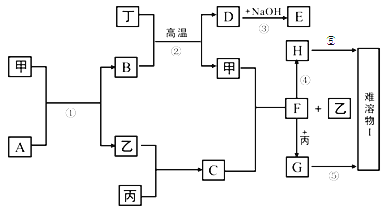
(1)写出下列物质化学式:B_________,F_______________;
(2)写出反应①的化学方程式:____________________;
(3)H在空气中很容易被氧化为I,该过程的实验现象是__________________;
(4)将足量的CO2通入E溶液中,离子方程式是___________________。
(5)将G的饱和溶液滴入沸水中得红褐色液体,该液体具有的性质有__________。
A.具有丁达尔现象 |
B.红褐色液体可用过滤的方法纯化 |
C.液体中分散质微粒直径小于1nm |
D.取适量液体加入K2SO4溶液会产生红褐色沉淀 |
【题目】苯甲醛是一种重要的化工原料,某小组同学利用如图所示实验装置(夹持装置已略去)制备苯甲醛。已知有机物的相关数据如下表所示:
有机物 | 沸点℃ | 密度为g/cm3 | 相对分子 质量 | 溶解性 |
苯甲醛 | 178.1 | 1.045 | 106 | 微溶于水,易溶于乙醇、醚和卤代烃 |
苯甲醇 | 205.7 | 1.045 | 108 | 微溶于水,易溶于乙醇、醚和卤代烃 |
二氯甲烷 | 39.8 | 1.33 | 难溶于水,易溶于有机溶剂 |

实验步骤:
①向容积为500mL的三颈烧瓶加入90.0mL质量分数为5%的次氯酸钠溶液(稍过量),调节溶液的pH为9~10后,加入3.1mL(约3.24g)苯甲醇、75.0mL二氯甲烷,不断搅拌。
②充分反应后,用二氯甲烷萃取水相3次,并将有机相合并。
③向所得有机相中加入无水硫酸镁,过滤,得到有机混合物。
④蒸馏有机混合物,得到1.908g苯甲醛产品。
请回答下列问题:
(1)仪器b的名称为______,搅拌器的作用是______。
(2)苯甲醇与NaClO反应的化学方程式为_______。
(3)步骤①中,投料时,次氯酸钠不能过量太多,原因是____;步骤③中加入无水硫酸镁,若省略该操作, 可能造成的后果是______。
(4)步骤②中,应选用的实验装置是___(填序号)。


(5)步骤④中,蒸馏温度应控制在_______左右。
(6)本实验中,苯甲醛的产率为________(保留到小数点后一位)。