题目内容
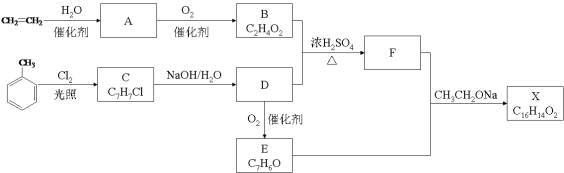
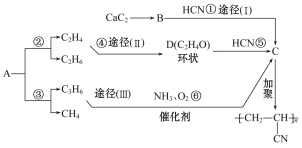
【题目】人造羊毛的主要成分为![]() ,此物质可由以下三种途径合成,已知A是石油分馏的一种产品,A均裂可生成等物质的量的C2H4和C2H6。
,此物质可由以下三种途径合成,已知A是石油分馏的一种产品,A均裂可生成等物质的量的C2H4和C2H6。
回答下列问题:
(1)写出A的分子式______,D的结构式______。
(2)在反应①~⑥中,属于加成反应的是________。
(3)写出反应⑥的化学反应方程式:____________。
(4)从能源和环保的角度看,你认为最有发展前景的是_____,其中的理由是______。
【答案】C4H10 ![]() ①④ 2CH2
①④ 2CH2![]() CH—CH3+2NH3+3O2
CH—CH3+2NH3+3O2![]() 2CH2
2CH2![]() CH—CN+6H2O 途径(Ⅲ) ①原料来源丰富;②生产过程能耗低,产品产率高;③生产过程污染少
CH—CN+6H2O 途径(Ⅲ) ①原料来源丰富;②生产过程能耗低,产品产率高;③生产过程污染少
【解析】
根据人造羊毛的结构简式,推出C的结构简式为CH2=CHCN,根据合成路线,A均裂可生成等物质的量的C2H4和C2H6,利用原子守恒,推出A的分子式为C4H10,CaC2生成B,则B为乙炔,D为环状,其分子式为C2H4O,即D为环氧乙烷,结构简式为![]() ,然后在进行分析;
,然后在进行分析;
根据人造羊毛的结构简式,推出C的结构简式为CH2=CHCN,根据合成路线,A均裂可生成等物质的量的C2H4和C2H6,利用原子守恒,推出A的分子式为C4H10,CaC2生成B,则B为乙炔,D为环状,其分子式为C2H4O,即D为环氧乙烷,结构简式为![]() ,
,
(1)由反应②③逆推,可知A的分子式为C4H10;D的分子式为C2H4O,其结构为环状,只能是环氧乙烷,其结构简式为![]() ;
;
(2)由![]() 逆推得C:CH2
逆推得C:CH2![]() CH—CN,B为HC≡CH,①为加成反应;④反应为:CH2
CH—CN,B为HC≡CH,①为加成反应;④反应为:CH2![]() CH2
CH2![]()
![]() 该反应符合加成反应的概念[有机分子是双键(或叁键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应],也是加成反应;⑤反应是取代反应:
该反应符合加成反应的概念[有机分子是双键(或叁键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应],也是加成反应;⑤反应是取代反应:![]() +H—CN
+H—CN![]() CH2
CH2![]() CH—CN+H2O;⑥反应也是取代反应:CH2
CH—CN+H2O;⑥反应也是取代反应:CH2![]() CH—CH3
CH—CH3![]() CH2
CH2![]() CH—CN;符合条件的是①④;
CH—CN;符合条件的是①④;
(3)⑥反应的结果是1个氮原子代替了3个氢原子,氮原子可由NH3提供,这样游离的6个氢原子将被![]() 个O2分子接受。据此,可写出⑥的反应方程式2CH2
个O2分子接受。据此,可写出⑥的反应方程式2CH2![]() CH—CH3+2NH3+3O2
CH—CH3+2NH3+3O2![]() 2CH2
2CH2![]() CH—CN+6H2O;
CH—CN+6H2O;
(4)从环保角度看,途径(Ⅰ)(Ⅱ)都使用了HCN,HCN有毒,对环境有危害,其发展前景不及途径(Ⅲ),从能源角度看,途径(Ⅰ)使用了CaC2,而合成CaC2需要耗费大量的电能,其发展前景不及途径(Ⅱ)和(Ⅲ);途径(Ⅱ)( Ⅲ)相比,途径(Ⅱ)反应环节多,需要设备多,途径(Ⅲ)使用了催化剂,耗能少,故途径(Ⅱ)的发展前景又不及途径(Ⅲ)。

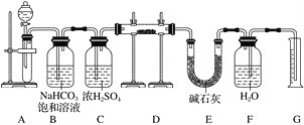
【题目】为验证氧化性:Cl2>Fe3+>SO2,某化学研究性学习小组用如图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕):
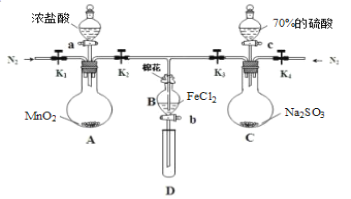
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_____________。
(2)棉花中浸润的溶液为________________,作用是____________ 。
(3)导致步骤Ⅲ中溶液变黄的离子反应是__________,用________(写试剂化学式)检验氧化产物,现象是____________。
(4)能说明氧化性Fe3+>SO2的离子方程式是___________。
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:Cl2>Fe3+>SO2的是_______(填“甲”“乙”“丙”)。
过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有 |
乙 | 既有Fe3+又有Fe2+ | 有 |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |