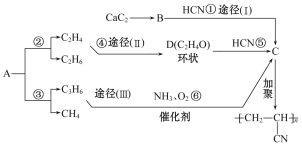
题目内容
【题目】为验证氧化性:Cl2>Fe3+>SO2,某化学研究性学习小组用如图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕):
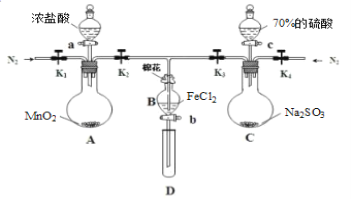
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_____________。
(2)棉花中浸润的溶液为________________,作用是____________ 。
(3)导致步骤Ⅲ中溶液变黄的离子反应是__________,用________(写试剂化学式)检验氧化产物,现象是____________。
(4)能说明氧化性Fe3+>SO2的离子方程式是___________。
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:Cl2>Fe3+>SO2的是_______(填“甲”“乙”“丙”)。
过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有 |
乙 | 既有Fe3+又有Fe2+ | 有 |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
【答案】排除装置中的空气,制造无氧环境 氢氧化钠 吸收逸出的二氧化硫和氯气 Cl2 +2Fe2+ =2Fe3+ +2Cl- KSCN溶液 溶液变为血红色 2Fe3+ + SO2 + 2H2O = 2Fe2+ + 4H+ +![]() 乙 和 丙
乙 和 丙
【解析】
本实验目的是验证氧化性:Cl2>Fe3+>SO2,根据氧化还原反应的规律可知,若氯气可以氧化Fe2+生成Fe3+,则可以证明氯气的氧化性大于Fe3+,Fe3+可以氧化SO2生成SO![]() 则可以证明Fe3+氧化性大于SO2。据此进行实验,首先为避免氧气的影响,所以要先用氮气排尽装置中的空气,之后利用装置A制取氯气,通入B装置中,通过溶液的颜色变化确定氯化亚铁被氧化成氯化铁;之后再利用装置C制取SO2,通入装置B中,再次通过溶液的颜色变化确定SO2将Fe3+还原成Fe2+;浸有碱液的棉花可以吸收未反应的氯气和二氧化硫。
则可以证明Fe3+氧化性大于SO2。据此进行实验,首先为避免氧气的影响,所以要先用氮气排尽装置中的空气,之后利用装置A制取氯气,通入B装置中,通过溶液的颜色变化确定氯化亚铁被氧化成氯化铁;之后再利用装置C制取SO2,通入装置B中,再次通过溶液的颜色变化确定SO2将Fe3+还原成Fe2+;浸有碱液的棉花可以吸收未反应的氯气和二氧化硫。
(1)空气中的氧气具有氧化性,会干扰实验,所以需要先通氮气,排除装置中的空气,制造无氧环境;
(2)二氧化硫和氯气均有毒,需要进行尾气处理,可以用浸有NaOH溶液的棉花来吸收逸出的二氧化硫和氯气;
(3)步骤Ⅲ中氯化亚铁被氯气氧化成氯化铁,溶液颜色发生变化,离子方程式为Cl2 +2Fe2+ =2Fe3+ +2Cl-;可以用KSCN溶液检验Fe3+,有Fe3+生成时,溶液会变为血红色;
(4)Fe3+可以氧化SO2生成SO![]() ,离子方程式为2Fe3++SO2+2H2O = 2Fe2++4H++
,离子方程式为2Fe3++SO2+2H2O = 2Fe2++4H++![]() ;
;
(5)甲:IV中B溶液含有铁离子说明氧化性Cl2>Fe3+,VI中B溶液含有硫酸根离子,若B溶液中氯气有剩余,则氯气会氧化二氧化硫生成硫酸根离子,不能判断氧化性Fe3+>SO2;
乙:IV中B溶液含有Fe3+和Fe2+,说明氧化性Cl2>Fe3+且氯气不足,所以VI中B溶液含有硫酸根离子,则一定是Fe3+氧化二氧化硫为硫酸根离子,所以判断氧化性Fe3+>SO2,因此可得氧化性Cl2>Fe3+>SO2的结论;
丙:IV中B溶液含有铁离子说明氧化性Cl2>Fe3+,VI中B溶液含有Fe2+,若是氯气氧化二氧化硫,不会有Fe2+生成,说明铁离子与二氧化硫发生氧化还原反应,Fe3+被还原为Fe2+,所以氧化性Fe3+>SO2,因此可得氧化性Cl2>Fe3+>SO2的结论;
综上所述能够证明氧化性:Cl2>Fe3+>SO2的是乙、丙。