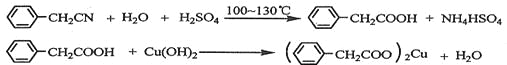
题目内容
【题目】LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:

已知:HCl的沸点是﹣85.0℃,HF的沸点是19.5℃。
(1)第①步反应中无水HF的作用是______________。反应设备不能用玻璃材质的原因是______________________(用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的___________溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:_______________________________。
(3)第④步分离采用的方法是_________;第⑤步分离尾气中HF、HCl采用的方法是______。
(4)LiPF6产品中通常混有少量LiF。取样品wg,测得Li的物质的量为nmol,则该样品中LiPF6的物质的量为______mol(用含w、n的代数式表示)。
【答案】(1)作溶剂和反应物 SiO2+4HF=SiF4↑+2H2O NaHCO3
(2)PF5+4H2O=H3PO4+5HF
(3)过滤 冷凝
(4)![]() mol
mol
【解析】试题分析:(1)根据题目中的流程可以看出,固体+液体→新物质+饱和溶液,所以无水HF的作用是反应物和溶剂;玻璃的主要成分中含有二氧化硅,能和HF发生反应,化学方程式为SiO2+4HF═SiF4↑+2H2O;HF属于弱酸,必须用弱碱性溶液来除去(比如2%的NaHCO3溶液);(2)根据题目中的信息“PF5极易水解,其产物为两种酸”,则根据元素组成可知,两种酸分别是H3PO4和HF,所以反应的方程式为PF5+4H2O═H3PO4+5HF,(3)第④步分离的是固体(LiPF4(s))和液体(HF(l)),所以采用过滤的方法;分离尾气中HF、HCl,可以利用二者沸点的差异(HF分子之间存在氢键)进行分离,所以采用冷凝法;(4)设LiPF6为xmol,LiF为ymol;根据Li守恒,有x+y=n,根据质量守恒有152x+26y=w,解得x=(w-26n):126moL。

 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】(13分)乙酸正丁酯是一种水果香味的无色透明液体,常用于调制香料和药物。实验室用正丁醇和乙酸制备,反应原理如下:
CH3COOH+CH3CH2CH2CH2OH![]() CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
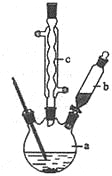
某兴趣小组拟用如图装置制备少量乙酸正丁酯:

步骤1:加料。向干燥的100ml圆底烧瓶中加入37ml正丁醇、22ml冰醋酸及10滴浓硫酸(试剂加入顺序未确定),摇匀后,加入几粒沸石。然后安装分水器(先在分水器上端小心加水至分水器支管口处,然后再放出1~2ml的水)及回流冷凝管。
步骤2:加热回流。通过活塞控制分水器中水层液面的高度。反应完毕,停止加热。
步骤3:冷却(不可以拆卸回流冷凝管)。冷却至室温后,将烧瓶中的混合物与分水器中的酯层合并,转入分液漏斗中。
步骤4:依次用10ml水,10ml 10%碳酸钠溶液洗至中性(pH=7),再水洗一次,向洗涤后的有机相中加入适量的无水硫酸镁固体。放置一段时间后过滤、蒸馏、收集124~126℃馏分,得产品)
步骤5:用一干燥的小烧杯称产品,重量为29.0g。
相关物质的性质如下表:
物质名称 | 沸点/℃ | 熔点/℃ | 密度/g·cm-3 | 水中溶解度 |
正丁醇 | 117.3 | -89.5 | 0.80 | 7.1g/100g |
乙酸 | 118 | 16.6 | 1.0492 | 互溶 |
乙酸正丁酯 | 126.1 | -78 | 0.8826 | 1.4g/100g |
根据题意完成下列填空:
(1)加料时,三种试剂的加入顺序为 。
(2)该实验中,冷凝水从 (填“a”或“b”)口通入,使用分水器的目的是 。
(3)步骤2中判断反应结束的现象是 。
(4)步骤3中从分液漏斗中得到酯的操作 ,用10% Na2CO3溶液洗涤有机相,是为了除去有机相中的 (填结构简式)。
(5)步骤4中加入无水硫酸镁固体的作用是 。
(6)实验中正丁醇的转化率为 。