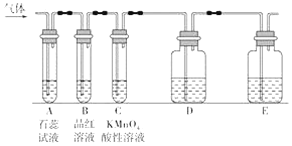
题目内容
【题目】下列装置或操作能达到实验目的的是( )(必要的夹持装置及石棉网已省略)
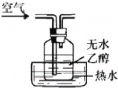
A. 实验室制备乙酸乙酯
实验室制备乙酸乙酯
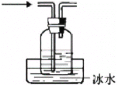
B.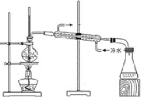 实验室中分馏石油
实验室中分馏石油
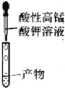
C.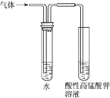 检验溴乙烷在NaOH乙醇溶液中反应生成的乙烯
检验溴乙烷在NaOH乙醇溶液中反应生成的乙烯
D.![]() 用苯萃取碘酒中的碘
用苯萃取碘酒中的碘
【答案】C
【解析】
A.实验室制备乙酸乙酯时,玻璃导管不能插入饱和碳酸钠溶液中,防止发生倒吸,A项错误;
B.蒸馏操作时应当使用具有支管的蒸馏烧瓶,并且温度计水银球的位置应与蒸馏烧瓶支管口平齐;此外,锥形瓶收集馏分时,一般不能用橡胶塞塞住,防止装置内压强过高发生危险,为避免馏分的挥发,可以将装置图中的锥形瓶改为下图: ,B项错误;
,B项错误;
C.气体通过水,可以除去挥发出来的乙醇蒸气,乙烯难溶于水,若看到酸性高锰酸钾溶液褪色,说明生成了乙烯,C项正确;
D.碘易溶于酒精,苯和酒精混溶,不能用苯萃取的方法分离,D项错误;
答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】25 ℃时,0.1 mol·L-1HA溶液中 =108,0.01 mol·L-1BOH溶液pH=12。请回答下列问题:
=108,0.01 mol·L-1BOH溶液pH=12。请回答下列问题:
(1)HA的电离常数Ka为________,BOH是________(填“强电解质”或“弱电解质”)。
(2)pH相等的BOH溶液与BA溶液,分别加热到相同的温度后BOH溶液的pH________(填“>”“=”或“<”)BA溶液的pH。
(3)已知碳酸的Ka1=4.3×10-7,Ka2=5.6×10-11,向等浓度的Na2CO3和NaA的溶液中滴加盐酸直至过量,则与H+作用的粒子依次为___________________。
(4)25 ℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=___________________。
②0.10 mol·L-1 NaHSO3溶液中离子浓度由大到小的顺序为_____________________。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为______________________。