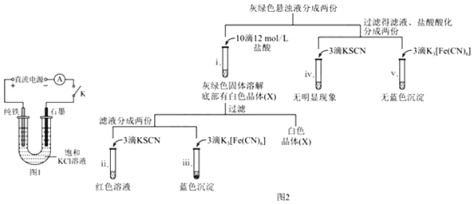
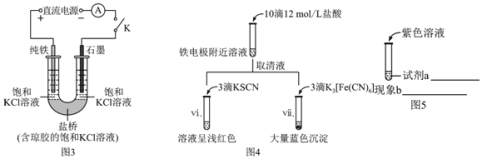
题目内容
【题目】Ⅰ.为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于50mL密度为1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如图所示。请依图回答下列问题:

(1)放出一半气体所需要的时间为______;
(2)A、B、C、D各点反应速率快慢的顺序是________;
(3)过氧化氢溶液的初始物质的量浓度为________。(保留2位小数)
Ⅱ.汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)![]() 2NO(g) ΔH>0,已知该反应在2404 ℃时,平衡常数K=64×10-4。
2NO(g) ΔH>0,已知该反应在2404 ℃时,平衡常数K=64×10-4。
(1)某温度下,向2 L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,N2的反应速率为_________, 此时N2 的转化率______。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志_____(填字母序号)。
A.消耗1mol N2同时生成1mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v正(N2)=v逆(NO)
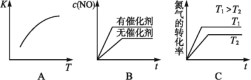
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,图变化趋势正确的是________(填字母序号)。
(4)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol·L-1、4.0×10-2mol·L-1和3.0×10-3mol·L-1,此时反应v正 _____v逆。
(5)某生提出,下列方法可以冶炼钢铁:FeO(s)+C(s)=Fe(s)+CO(g) ΔH>0,ΔS>0,上述反应在_____(低温或高温)条件下能自发进行。
(6)现有反应:CO2(g)+H2(g)CO(g)+H2O(g) ΔH>0,如图表示反应Ⅱ在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,则图中t2时刻发生改变的条件可能是_______。

A.升高温度
B.降低温度
C.加入催化剂
D.增大压强
E.减小压强
F.充入CO2
G.分离出部分CO
【答案】1min D > C > B > A 0.11mol/L 0.05mol/(L·min) 50% AD AC > 高温 B
【解析】
Ⅰ.(1)由图象可知,当放出一半气体所需要的时间为1min;
(2)反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小,故答案为:D>C>B>A;
(3)由反应方程式为:2H2O2![]() 2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,
2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,
由图象可知,生成氧气的体积为60mL,
2H2O2![]() 2H2O+O2↑
2H2O+O2↑
2mol 22.4L
n(H2O2) 0.06L
n(H2O2)=![]() =0.00536mol,所以c(H2O2)=
=0.00536mol,所以c(H2O2)=![]() =0.11mol·L-1;
=0.11mol·L-1;
Ⅱ.(1)根据化学反应速率数学表达式,v(N2)=![]() mol·L-1·min-1=0.05mol·L-1·min-1;
mol·L-1·min-1=0.05mol·L-1·min-1;
根据反应N2(g)+O2(g)![]() 2NO(g),消耗N2的物质的量为0.5mol,此时N2 的转化率为
2NO(g),消耗N2的物质的量为0.5mol,此时N2 的转化率为![]() ;
;
(2)A、用不同物质的反应速率表示达到平衡,要求反应方向一正一逆,且反应速率之比等于系数之比,选项A正确;
B、ρ=![]() ,条件是恒容,v不变,反应物和生成物都是气体,气体质量不变,因此密度不能作为达到平衡的标志,选项B错误;
,条件是恒容,v不变,反应物和生成物都是气体,气体质量不变,因此密度不能作为达到平衡的标志,选项B错误;
C、M=![]() ,气体的质量不变,气体系数之和相等,n不变,因此平均相对分子质量不变,不能作为达到平衡的标志,选项C错误;
,气体的质量不变,气体系数之和相等,n不变,因此平均相对分子质量不变,不能作为达到平衡的标志,选项C错误;
D、2v正(N2)= v正(NO)=v逆(NO),正逆反应速率相等,反应达平衡状态,选项D正确;
答案选AD;
(3)A、化学平衡常数K=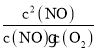 ,此反应是吸热反应,升高温度,平衡向正反应方向移动,化学平衡常数只受温度的影响,因此随着温度的升高,化学平衡常数增大,选项A正确;
,此反应是吸热反应,升高温度,平衡向正反应方向移动,化学平衡常数只受温度的影响,因此随着温度的升高,化学平衡常数增大,选项A正确;
B、催化剂只增大反应速率,对化学平衡无影响,选项B错误;
C、先拐先平衡,说明反应速率快,即T1>T2,此反应是吸热反应,升高温度,平衡向正反应方向移动,N2的转化率增大,选项C正确;
答案选AC;
(4)此时的Qc=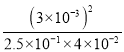 =9×10-4,上述反应达到平衡时的化学平衡常数为K=64×10-4,Qc<K,说明反应向正反应方向移动,v正>v逆;
=9×10-4,上述反应达到平衡时的化学平衡常数为K=64×10-4,Qc<K,说明反应向正反应方向移动,v正>v逆;
(5)反应FeO(s)+C(s)=Fe(s)+CO(g) ΔH>0,ΔS>0,根据ΔG=ΔH-TΔS<0时能自发进行,则高温有利于自发进行,故反应在高温条件下能自发进行;
(6)CO(g)+H2O(g)H2(g)+CO2(g),反应是气体体积不变的放热反应,在t2时刻因改变某个条件浓度发生变化的情况是二氧化碳浓度增大,一氧化碳浓度减小,说明平衡逆向进行,降低温度或增加水蒸气的量或减少氢气的量均可以实现;答案为:B。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案【题目】(1)火箭使用的推进剂燃料由N、H两种元素组成,且原子个数N:H=1:2,其水溶液显碱性,则该物质中N原子的杂化方式为______________________。
(2)笑气(N2O)曾被用作麻醉剂,但过度吸食会导致身体机能紊乱。预测N2O的结构式为________________________。
(3)元素的基态气态原子得到一个电子形成气态-1价离子时所放出的能量称作第一电子亲和能(E),-1价阴离子再获得一个电子的能量变化叫做第二电子亲和能,部分元素或离子的电子亲和能数据如下表所示。
元素 | C1 | Br | I | O | O- |
电子亲和能(kJ/mol) | 349 | 343 | 295 | 141 | -780 |
下列说法正确的是___________。
A.电子亲和能越大,说明越难得到电子
B.一个基态的气态氧原子得到一个电子成为O2-时放出141kJ的能量
C.氧元素的第二电子亲和能是-780kJ/mol
D.基态的气态氧原子得到两个电子成为O2-需要吸收能量
(4)在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为:2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空:
①冰晶石的化学式为____________________________。
②冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是___________(填微粒符号)。
③冰晶石溶液中不存在的微粒间作用力有________________(填选项字母)。
A 离子键 B 共价键 C 配位键 D 金属键 E 范德华力 F 氢键
④Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:

若已知A1的原子半径为d cm,NA代表阿伏加德罗常数,Al的相对原子质量为M,则晶胞中Al原子的配位数为________;Al晶体的密度为__________g.cm-3(用字母表示)。
(5)配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示。

①Fe(CO)5晶体类型属于__________晶体。
②关于Fe(CO)5,下列说法正确的是_____。
A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1mol Fe(CO)5含有10mol配位键
D.反应Fe(CO)5=Fe+5CO没有新化学键生成