题目内容
下列各变化中属于原电池的反应的是
| A.在空气中金属铝表面迅速氧化形成保护层 |
| B.从海水中通过化学方法得到金属镁 |
| C.红热的铁丝与冷水接触,表面表成蓝黑色保护层 |
| D.锌和稀硫酸反应时,加入少量的CuSO4溶液可使反应加快 |
D
解析试题分析:原电池的本质是氧化还原反应。形成原电池的条件:1.活泼性不同的电极材料2.电解质溶液3.形成闭合回路4.自发进行的氧化还原反应。因此符合上述条件的只有D选项。
考点:考查原电池形成条件的相关知识点

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
菱镁矿是碱性耐火材料的主要原料,其主要的化学成分是:MgCO3,同时含有杂质:SiO2、Al2O3、Fe2O3、CaO等;目前以菱镁矿为主要原料制备MgSO4的方法如下:
已知:①常温下,Fe3+、Al3+、Mg2+开始形成氢氧化物沉淀和沉淀完全时的pH值如下:
| | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀 | 2.1 | 3.7 | 9.0 |
| 沉淀完全 | 3.2 | 5.2 | 12.4 |
(1)用平衡原理解释:菱镁矿粉粹后加热生成的氧化镁可以溶解在硫酸铵溶液中的原因 。
(2)在该工业流程中,可以循环使用的物质是 。
(3)步骤③中氨气和硫酸恰好完全反应,取此时所得的溶液10.00mL配成250mL溶液,配制溶液过程中除烧杯、玻璃棒、胶头滴管、酸式滴定管外,还需要的玻璃仪器有: ;经检测所配制的溶液pH=1,c(SO42ˉ)=1.05mol/L,试求算所配制溶液中NH4+ 水解的平衡常数K(写计算过程,计算结果保留三位有效数字)。
(4)在加热条件下杂质中的三氧化二铁溶于硫酸铵的离子反应方程式是:
。
(5)蒸发结晶过程中需要使用60~70℃水浴加热方式,其原因是 。
高铁电池是电动汽车首选的电池之一,该电池的工作原理为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列关于该电池放电时的说法中正确的是 ( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列关于该电池放电时的说法中正确的是 ( )
| A.高铁电池产生的电流从负极经外电路到达正极 |
| B.正极反应式为Zn+2OH-—2e - =Zn(OH)2 |
| C.负极pH减小,正极pH增大,电解液pH增大 |
| D.每氧化1mol高铁酸钾转移3mol电子 |
如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2=Fe+2Li2S。下列说法不正确的是
| A.可以用水代替SO(CH3)2做溶剂 | B.电子移动方向是由a极流向b极 |
| C.该装置将化学能转化为电能 | D.b极反应式是FeS2+4Li++4e-=Fe+2Li2S |
对铜—锌—稀硫酸组成的原电池装置中,当导线中有1mol电子通过时,理论上的两极变化是①锌片溶解了32.5克 ②锌片增重了32.5克 ③铜片上析出1克氢气④铜片上析出1mol氢气
| A.①③ | B.①④ | C.②③ | D.②④ |
下列防腐措施中,利用原电池反应使主要金属得到保护的是( )
| A.用氧化剂使金属表面生成致密稳定的氧化物保护膜 |
| B.在金属中加入一些铬或镍制成合金 |
| C.在轮船的壳体水线以下部分装上锌锭 |
| D.金属表面喷漆 |
利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是
| A.电解时以精铜作阳极 |
| B.电解时阴极发生还原反应 |
| C.粗铜连接电源负极,其电极反应是Cu =Cu2+ + 2e- |
| D.电解结束,电解槽底部会形成含少量Ag、Pt等金属的阳极泥 |
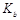 = mol·L-1。
= mol·L-1。