题目内容
菱镁矿是碱性耐火材料的主要原料,其主要的化学成分是:MgCO3,同时含有杂质:SiO2、Al2O3、Fe2O3、CaO等;目前以菱镁矿为主要原料制备MgSO4的方法如下:
已知:①常温下,Fe3+、Al3+、Mg2+开始形成氢氧化物沉淀和沉淀完全时的pH值如下:
| | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀 | 2.1 | 3.7 | 9.0 |
| 沉淀完全 | 3.2 | 5.2 | 12.4 |
(1)用平衡原理解释:菱镁矿粉粹后加热生成的氧化镁可以溶解在硫酸铵溶液中的原因 。
(2)在该工业流程中,可以循环使用的物质是 。
(3)步骤③中氨气和硫酸恰好完全反应,取此时所得的溶液10.00mL配成250mL溶液,配制溶液过程中除烧杯、玻璃棒、胶头滴管、酸式滴定管外,还需要的玻璃仪器有: ;经检测所配制的溶液pH=1,c(SO42ˉ)=1.05mol/L,试求算所配制溶液中NH4+ 水解的平衡常数K(写计算过程,计算结果保留三位有效数字)。
(4)在加热条件下杂质中的三氧化二铁溶于硫酸铵的离子反应方程式是:
。
(5)蒸发结晶过程中需要使用60~70℃水浴加热方式,其原因是 。
(16分)
(1)因NH4++H2O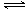 NH3·H2O+H+,MgO+ 2H+=Mg2++H2O,氧化镁消耗氢离子,铵根离子水解平衡向右进行,不断提供H+使MgO不断溶解(3分)(写出两个方程式就给2分,平衡向右移动给1分)
NH3·H2O+H+,MgO+ 2H+=Mg2++H2O,氧化镁消耗氢离子,铵根离子水解平衡向右进行,不断提供H+使MgO不断溶解(3分)(写出两个方程式就给2分,平衡向右移动给1分)
(2)(NH4)2SO4(2分)
(3)250ml容量瓶(2分,没有规格不给分) K=5.00×10-3 mol?Lˉ1(计算过程见解析)
(4)Fe2O3+ 6NH4+ =6NH3↑+2Fe3++3H2O(条件:加热)(没有写条件和气体呼号扣1分,没配平扣1分;共2分)
(5)避免加热蒸发过程中MgSO4·7H2O失去部分或全部的结晶水(2分)
解析试题分析:(1)硫酸铵溶液中存在如下水解平衡:NH4++H2O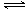 NH3?H2O+H+,氧化镁与氢离子反应,生成镁离子和水,减小氢离子浓度,促进铵根离子的水解平衡右移,生成的氢离子又溶解菱镁矿粉粹后加热生成的氧化镁;(2)步骤③生成硫酸铵,步骤②消耗硫酸铵,说明该工艺流程中,硫酸铵是可以循环利用的物质;(3)配制250mL溶液需要的玻璃仪器是烧杯、玻璃棒、250mL容量瓶、胶头滴管、酸式滴定管等;氨气和硫酸反应所得溶液中含有H+、NH4+、OH-,根据电荷守恒原理可得:c(H+)+c(NH4+)=2c(SO42ˉ),由于pH=1,则溶液中c(H+)=0.1mol/L,c(SO42ˉ)=1.05mol/L,所以c(NH4+)=2.0mol/L;由于(NH4)2SO4=2NH4++SO42ˉ,则没有水解时c(NH4+)="2" c(SO42ˉ)=2.1mol/L;由三行数据法得:
NH3?H2O+H+,氧化镁与氢离子反应,生成镁离子和水,减小氢离子浓度,促进铵根离子的水解平衡右移,生成的氢离子又溶解菱镁矿粉粹后加热生成的氧化镁;(2)步骤③生成硫酸铵,步骤②消耗硫酸铵,说明该工艺流程中,硫酸铵是可以循环利用的物质;(3)配制250mL溶液需要的玻璃仪器是烧杯、玻璃棒、250mL容量瓶、胶头滴管、酸式滴定管等;氨气和硫酸反应所得溶液中含有H+、NH4+、OH-,根据电荷守恒原理可得:c(H+)+c(NH4+)=2c(SO42ˉ),由于pH=1,则溶液中c(H+)=0.1mol/L,c(SO42ˉ)=1.05mol/L,所以c(NH4+)=2.0mol/L;由于(NH4)2SO4=2NH4++SO42ˉ,则没有水解时c(NH4+)="2" c(SO42ˉ)=2.1mol/L;由三行数据法得:
NH4++H2O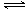 NH3?H2O+H+
NH3?H2O+H+
各组分起始浓度/mol?Lˉ1 2.1 0 0
各组分变化浓度/mol?Lˉ1 0.1 0.1 0.1
各组分平衡浓度/mol?Lˉ1 2.0 0.1 0.1
K=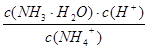 =
= =5.00×10-3 mol?Lˉ1;
=5.00×10-3 mol?Lˉ1;
(4)先写硫酸铵水解反应:NH4++H2O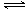 NH3·H2O+H+,再写Fe2O3+6H+=2Fe3++3H2O,前者×6+后者可得:Fe2O3+6NH4++3H2O=6NH3·H2O+2Fe3+,加热时6NH3·H2O
NH3·H2O+H+,再写Fe2O3+6H+=2Fe3++3H2O,前者×6+后者可得:Fe2O3+6NH4++3H2O=6NH3·H2O+2Fe3+,加热时6NH3·H2O  6NH3+6H2O,则Fe2O3+6NH4+=6NH3↑+2Fe3++3H2O;(5)蒸发结晶得到的目标产物是MgSO4·7H2O,加热温度过低,蒸发结晶速率过低,加热温度过高,结晶析出的MgSO4·7H2O失去部分或全部的结晶水,因此蒸发结晶过程中需要使用60~70℃水浴加热方式。
6NH3+6H2O,则Fe2O3+6NH4+=6NH3↑+2Fe3++3H2O;(5)蒸发结晶得到的目标产物是MgSO4·7H2O,加热温度过低,蒸发结晶速率过低,加热温度过高,结晶析出的MgSO4·7H2O失去部分或全部的结晶水,因此蒸发结晶过程中需要使用60~70℃水浴加热方式。
考点:考查物质制备工艺流程,涉及利用平衡移动原理解释原因、循环利用的物质、配制一定体积溶液使用的玻璃仪器、化学平衡常数的计算、pH的计算、氧化铁溶于硫酸铵溶液的离子方程式、蒸发结晶采取水浴加热的原因、七水硫酸镁的稳定性等。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。请完成下列填空:
| 实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
| 1 | 20.00 | 0.10 | 24.18 |
| 2 | 20.00 | 0.10 | 23.06 |
| 3 | 20.00 | 0.10 | 22.96 |
(1)滴定达到终点的标志是 。
(2)根据上述数据,可计算出该盐酸的浓度约为 (保留小数点后叁位)。
(3)若滴定结束时,碱式滴定管中的液面如图所示,终点读数为 mL。

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
实验题
(1)烧碱在保存过程会部分变质(杂质主要为Na2CO3)。
准确称取5.0g样品配制成250mL溶液,各取配制好的烧碱溶液10.00mL于锥形瓶中,分别向锥形瓶中各加入1~2滴酚酞指示剂,(已知:酚酞变色时,此时只有NaOH与HCl反应,Na2CO3还没有与HCl反应)用浓度为0.20mol·L-1的盐酸标准液进行滴定。相关数据记录如下:
| 实验编号 | V(烧碱溶液)/mL | V(盐酸)/mL | |
| 初始读数 | 末尾读数 | ||
| 1 | 10.00 | 0.50 | 21.52 |
| 2 | 10.00 | 1.00 | 21.98 |
| 3 | 10.00 | 0.20 | 24.80 |
试回答:
①滴定时右手的正确操作是______________________________________。
②判断到达滴定终点的实验现象是__________________________________________,依据表中数据,计算出烧碱样品中含NaOH的质量分数为______ _%。
③下列操作会导致烧碱样品中NaOH含量测定值偏高的是__________。
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.滴定过程中振荡锥形瓶时,有少量待测溶液溅出
D.滴定前平视读数,滴定结束仰视读数
(2)氧化还原滴定实验同中和滴定类似。过氧化氢是重要的氧化剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的浓度。已知:2KMnO4+5H2O2+6H2SO4===2MnSO4+8H2O+5O2↑,请填写下列空白:
①用 (填“酸式”或“碱式”)滴定管移取过氧化氢溶液25.00 mL至锥形瓶中,作被测试样。
②滴定时,将高锰酸钾标准溶液注入酸式滴定管中,高锰酸钾标准溶液用酸式滴定管原因为 。③重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的物质的量浓度为 。
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 ,盛装标准盐酸的仪器名称为 ;滴定至终点的颜色变化为 。
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。
(3)乙学生做了三组平行实验,数据记录如下:
| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.29 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 1.00 | 27.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字)。
(4)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
下列与金属腐蚀有关的说法正确的是( )
| A.图a中,插入海水中的铁棒越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
下列各变化中属于原电池的反应的是
| A.在空气中金属铝表面迅速氧化形成保护层 |
| B.从海水中通过化学方法得到金属镁 |
| C.红热的铁丝与冷水接触,表面表成蓝黑色保护层 |
| D.锌和稀硫酸反应时,加入少量的CuSO4溶液可使反应加快 |
为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是 
| A.正极的电极方程式为:O2+2H2O+4e-===4OH- |
| B.将石墨电极改成Mg电极,难以观察到铁锈生成 |
| C.若向自来水中加入少量NaCl(s),可较快地看到铁锈 |
| D.向铁电极附近吹入O2比向石墨电极附近吹入O2,铁锈出现得快 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电
电压,高铁电池的总反应为


下列叙述不正确的是
A.充电时阳极反应为: |
B.放电时负极反应为: |
| C.放电时每转移3mol电子,正极有1molK2FeO4被氧化 |
| D.放电时正极附近溶液的碱性增强 |