题目内容
(1)AgNO3的水溶液常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): 实验室在配制AgNO3的溶液时为了抑制其水解,常将AgNO3固体先溶于较浓的 中,然后再用蒸馏水稀释到所需的浓度.(2)把FeCl3溶液加热蒸干,灼烧,最后得到的主要固体产物是 .
(3)比较下列溶液的pH值(填>.<.=)
①0.1mol?Lˉ1 NH4Cl溶液 0.01mol?Lˉ1 NH4Cl溶液
②0.1mol?Lˉ1 Na2CO3溶液 0.1mol?Lˉ1 NaHCO3溶液
(4)常温下有一pH为12的NaOH的溶液100mL,如果将其pH降为11,那么
①若用pH=10的NaOH溶液应加入 mL
②若用pH=2的盐酸应加入 mL.
【答案】分析:(1)AgNO3为强酸弱碱盐,Ag+离子水解使溶液呈酸性,从影响盐类水解平衡的因素综合分析;
(2)盐类水解为吸热过程,加热促进水解;
(3)NH4Cl水解呈酸性,浓度越大,溶液酸性越强;多元弱酸的酸根离子的水解以第一步水解为主;
(4)常温下有一pH为12的NaOH的溶液100mL,如果将其pH降为11,可用加水稀释、与稀溶液混合或加入酸部分中和的方法.
解答:解:(1)AgNO3为强酸弱碱盐,Ag+离子水解使溶液呈酸性,溶液pH<7,水解方程式为Ag++H2O AgOH+H+,在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,防止Ag+离子水解使溶液溶液浑浊,
AgOH+H+,在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,防止Ag+离子水解使溶液溶液浑浊,
故答案为:<;Ag++H2O?AgOH+H+;硝酸;
(2)盐类水解为吸热过程,加热FeCl3溶液生成FE(OH)3,进而分解生成Fe2O3,故答案为:Fe2O3;
(3)①NH4Cl水解呈酸性,浓度越大,溶液酸性越强,故答案为:<;
②多元弱酸的酸根离子的水解以第一步水解为主,且第一步水解程度远大于第二步水解,故答案为:>;
(4)常温下有一pH为12的NaOH的溶液100mL,如果将其pH降为11,则c(OH-)=0.001mol/L,
①设pH=10的NaOH溶液体积为V,则有c(OH-)=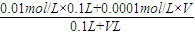 =0.001Lmol/L,
=0.001Lmol/L,
V=1L=1000mL,故答案为:1000;
②若用pH=2的盐酸,设盐酸的体积为x,则有c(OH-)=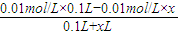 =0.001mol/L,
=0.001mol/L,
x=0.0818L=81.8mL,
故答案为:81.8.
点评:本题综合考查盐类水解的应用、原理以及酸碱混合的计算,题目难度中等,注意把握影响盐类水解平衡移动的因素.
(2)盐类水解为吸热过程,加热促进水解;
(3)NH4Cl水解呈酸性,浓度越大,溶液酸性越强;多元弱酸的酸根离子的水解以第一步水解为主;
(4)常温下有一pH为12的NaOH的溶液100mL,如果将其pH降为11,可用加水稀释、与稀溶液混合或加入酸部分中和的方法.
解答:解:(1)AgNO3为强酸弱碱盐,Ag+离子水解使溶液呈酸性,溶液pH<7,水解方程式为Ag++H2O
 AgOH+H+,在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,防止Ag+离子水解使溶液溶液浑浊,
AgOH+H+,在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,防止Ag+离子水解使溶液溶液浑浊,故答案为:<;Ag++H2O?AgOH+H+;硝酸;
(2)盐类水解为吸热过程,加热FeCl3溶液生成FE(OH)3,进而分解生成Fe2O3,故答案为:Fe2O3;
(3)①NH4Cl水解呈酸性,浓度越大,溶液酸性越强,故答案为:<;
②多元弱酸的酸根离子的水解以第一步水解为主,且第一步水解程度远大于第二步水解,故答案为:>;
(4)常温下有一pH为12的NaOH的溶液100mL,如果将其pH降为11,则c(OH-)=0.001mol/L,
①设pH=10的NaOH溶液体积为V,则有c(OH-)=
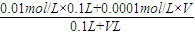 =0.001Lmol/L,
=0.001Lmol/L,V=1L=1000mL,故答案为:1000;
②若用pH=2的盐酸,设盐酸的体积为x,则有c(OH-)=
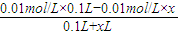 =0.001mol/L,
=0.001mol/L,x=0.0818L=81.8mL,
故答案为:81.8.
点评:本题综合考查盐类水解的应用、原理以及酸碱混合的计算,题目难度中等,注意把握影响盐类水解平衡移动的因素.

练习册系列答案
相关题目