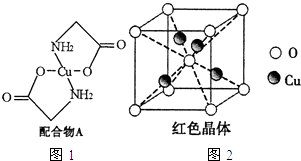
题目内容
【题目】向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng。再将得到的沉淀灼烧至质量不再改变为止,得到固体pg。则下列关系不正确的是( )
A. n=17Vc+m B. 5m/3<p<17m/9
C. p=m+cV/125 D. c=1000b/11.2V
【答案】A
【解析】反应化学方程式为:Mg+H2SO4=MgSO4+H2↑、2Al+3H2SO4=Al2(SO4)3+3H2↑、MgSO4+2KOH=Mg(OH)2↓+K2SO4、Al2(SO4)3+6KOH=2Al(OH)3↓+3K2SO4、Mg(OH)2![]() MgO+H2O;2Al(OH)3
MgO+H2O;2Al(OH)3![]() Al2O3+3H2O。A.得到的氢氧化镁和氢氧化铝的质量等于镁铝的质量和与氢氧根离子的质量之和,即n=m+17×c×V/1000=m+17Vc/1000,A错误;B.氧化镁和氧化铝的质量可以按照极值方法计算,若mg全是镁,得到的氧化物为氧化镁,根据元素守恒,则质量为p=40m/24=5m/3;若mg全是铝,得到的氧化物为氧化铝,根据元素守恒,则质量为p=
Al2O3+3H2O。A.得到的氢氧化镁和氢氧化铝的质量等于镁铝的质量和与氢氧根离子的质量之和,即n=m+17×c×V/1000=m+17Vc/1000,A错误;B.氧化镁和氧化铝的质量可以按照极值方法计算,若mg全是镁,得到的氧化物为氧化镁,根据元素守恒,则质量为p=40m/24=5m/3;若mg全是铝,得到的氧化物为氧化铝,根据元素守恒,则质量为p= ![]() ;得到的固体质量介于二者之间,即:5m/3<p<17m/9,B正确;C.p为生成的氧化物的质量,1molMg可结合1molO,2molAl结合3molO,因此生成沉淀的质量等于镁和铝的质量之和加氧元素的质量,而结合氧元素的物质的量等于生成氢气的物质的量,也等于消耗氢氧根离子的物质的量的一半;根据化学方程式的定量关系,生成的氢气的物质的量等于参加反应的NaOH的物质的量的一半,即生成氢气的物质的量为:c×V×103/2,则p=16×c×V×103/2+m=m+cV/125,C正确;D.根据化学方程式的定量关系,生成的氢气的物质的量等于参加反应的碱的物质的量的一半,即b=22.4L/mol×c×V×103/2,整理得c=1000b/11.2V,D正确;答案选A。
;得到的固体质量介于二者之间,即:5m/3<p<17m/9,B正确;C.p为生成的氧化物的质量,1molMg可结合1molO,2molAl结合3molO,因此生成沉淀的质量等于镁和铝的质量之和加氧元素的质量,而结合氧元素的物质的量等于生成氢气的物质的量,也等于消耗氢氧根离子的物质的量的一半;根据化学方程式的定量关系,生成的氢气的物质的量等于参加反应的NaOH的物质的量的一半,即生成氢气的物质的量为:c×V×103/2,则p=16×c×V×103/2+m=m+cV/125,C正确;D.根据化学方程式的定量关系,生成的氢气的物质的量等于参加反应的碱的物质的量的一半,即b=22.4L/mol×c×V×103/2,整理得c=1000b/11.2V,D正确;答案选A。

 阅读快车系列答案
阅读快车系列答案