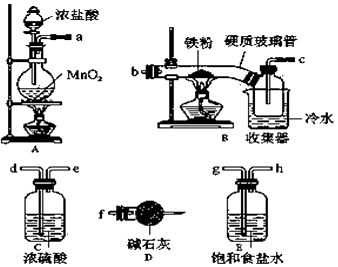
��Ŀ����
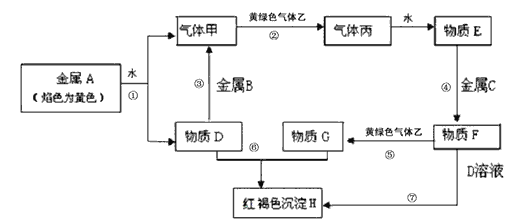
����Ŀ�����н�������A��B��C������ס��ҡ���������D��E��F��G��H������֮���ܷ������·�Ӧ��ͼ����Щ��Ӧ�IJ���ͷ�Ӧ������û��ȫ���������
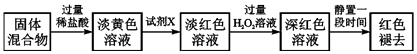
�����������Ϣ�ش��������⣺
��1��д���������ʵĻ�ѧʽ��A��_____ B��_____ F��______ ����______
��2��˵������ɫ�����ҵ�һ����;��____________________��
��3������ȥF��Һ�к��е�����G�������______��ʵ���Ҽ���G�������Ľ�������ʱ������G����Һ�м���_______________��Һ��
��4����Ӧ�ٵ����ӷ���ʽΪ_______________________________________��
��5����Ӧ���漰�Ļ�ѧ����ʽ��____________________________________��
���𰸡� Na Al FeCl2 HCl ����ˮ�������߹�ҵ������ Fe�� KSCN��Һ��NaOH��Һ 2Na+2H2O=2Na+ + 2OH- +H2�� FeCl2+2NaOH=Fe(OH)2��+2NaCl��4Fe(OH)2+O2+2H2O==4Fe(OH)3
������������A��ɫ��ӦΪ��ɫ����AΪ����Na���ɷ�Ӧ�ٿ�֪��DΪNaOH�������ΪH2���������������B��Ӧ�����������ʽ���BΪAl����������������G��Ӧ���ɺ��ɫ����H��Fe(OH)3��������G�к���Fe3+������ɫ����������������������Ӧ�����Ȼ��⣬�����Ȼ��⣬����ˮ�õ�E�����ᣬ����������Ӧ�����Ȼ��������Ȼ��������������������Ȼ������Ȼ��������������Ʒ�Ӧ����������������������CΪFe������FΪFeCl2������GΪFeCl3��HΪ������������
��1����������ķ�����֪��A��B��F�����ֱ���Na��Al��FeCl2��HCl����2����Ϊ������������������ˮ���������������3��FΪ�Ȼ�������GΪ�Ȼ�������ȥF��Һ�к��е�����G����������ۣ�ʵ���Ҽ���G�������Ľ�������ʱ������G����Һ�м���KSCN��Һ��NaOH��Һ����4����Ӧ�ٵ����ӷ���ʽΪ2Na+2H2O=2Na+ + 2OH�� +H2������5����Ӧ��Ϊ�Ȼ��������������Ʒ�Ӧ����Ӧ������������������������������������������������������������Ӧ�Ļ�ѧ����ʽΪFeCl2+2NaOH��Fe(OH)2��+2NaCl��4Fe(OH)2+O2+2H2O��4Fe(OH)3��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���屽��һ�ֻ���ԭ�ϣ�ʵ���Һϳ��屽��װ��ʾ��ͼ���й��������£�
�� | �� | �屽 | |
�ܶ�/gcm��3 | 0.88 | 3.10 | 1.50 |
�е�/�� | 80 | 59 | 156 |
ˮ���ܽ�� | �� | �� | �� |
��ش��������⣺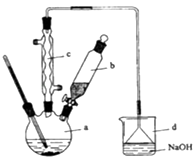
��1����a�м���15mL��ˮ����������м����b��С�ļ���4.0mLҺ̬�壮��a�е��뼸���壬�а�ɫ��������������Ϊ���������壮�����μ���Һ����꣮װ��d����������
��2��Һ�����������в�������ᴿ��
����a�м���10mLˮ��Ȼ����˳�ȥδ��Ӧ����м��
����Һ������10mLˮ��8mL10%��NaOH��Һ��10mLˮϴ�ӣ�NaOH��Һϴ�ӵ���������
����ֳ��Ĵ��屽�м�����������ˮ�Ȼ��ƣ����á����ˣ������Ȼ��Ƶ�Ŀ������
��3�������Ϸ���������屽�л����е���Ҫ����Ϊ �� Ҫ��һ���ᴿ�����в����б��������������ȷѡ��ǰ����ĸ����
A���ؽᾧ B������ C������ D����ȡ��