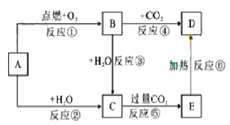
题目内容
【题目】某研究性学习小组得到一块软锰矿样品,其主要成分为二氧化锰( MnO2)和石英(SiO2)。为了制取Cl2和探究氯及其化合物的相关性质,进行如下实验。
【查阅资料】MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
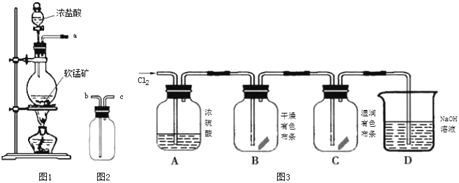
【制取气体】
(1)取适量矿样置于烧瓶中,加入足量浓盐酸并加热,充分反应后烧瓶中残留的固体是____。
(2)收集氯气应将图1导管的a接口与图2导管的_____________接口连接(填“b”或“c)。
(3)已知氯气中含有HCl杂质,可用______________除去。
【实验探究】
(4)把红热的铁丝伸入盛有氯气的集气瓶中,铁丝燃烧产生棕褐色的烟。反应的化学方程式是_______________________________________________________________________。
(5)按图3进行实验,观察到B中的有色布条不褪色,C中的有色布条褪色。由此得出的结论是_____________________________________________________________________。
(6)写出C中反应的化学方程式:_________________________________________________。
【联系实际】
(7)某氯碱工厂的氯气管道发生泄漏,以下采取的措施正确的是______________ (双项选择,填序号)。
A.将人群向高处疏散
B.将人群向低处疏散
C.关闭氯气管道,用碱液浸泡过的棉布覆盖泄漏部位
D.关闭氯气管道,用饱和NaCl溶液浸泡过的棉布覆盖泄漏部位
【答案】 SiO2 b 饱和食盐水 2Fe+3Cl2=2FeCl3 干燥的氯气没有漂白作用,而氯气与水反应产生的次氯酸具有漂白作用 Cl2+H2O![]() HCl+HClO AC
HCl+HClO AC
【解析】(1)加入足量浓盐酸并加热,二氧化锰完全反应,而二氧化硅与浓盐酸不反应,反应后剩余的固体为二氧化硅;正确答案:SiO2。
(2)氯气的密度比空气大,只能用向上排空气法收集气体,因此导气管要长进短出,a接口与图2导管的b相连接;正确选项b 。
(3)氯化氢极易溶于水,而氯气在饱和氯化钠溶液中几乎不溶,因此可以用饱和食盐水来除去氯气中含有HCl杂质;正确答案:饱和食盐水。
(4)铁丝在氯气中燃烧生成氯化铁;正确答案:2Fe+3Cl2=2FeCl3。
(5)氯气与水反应产生的次氯酸具有漂白作用,因此干燥的氯气无漂白作用,而潮湿的氯气有漂白作用;正确答案:干燥的氯气无漂白作用,而氯气与水反应产生的次氯酸具有漂白作用。
(6)氯气与水反应生成盐酸和次氯酸:Cl2+H2O![]() HCl+HClO;正确答案:Cl2+H2O
HCl+HClO;正确答案:Cl2+H2O![]() HCl+HClO。
HCl+HClO。
(7)氯气的密度比空气大,因此将人群向高处疏散;A正确,B错误;氯气与氯化钠溶液不反应,而且氯气在氯化钠溶液中几乎不溶,因此用饱和NaCl溶液浸泡过的棉布覆盖泄漏部位,没什么作用;氯气能够与碱反应,用碱液浸泡过的棉布覆盖泄漏部位,可以吸收泄露出来氯气;C正确,D错误;正确选项AC。