题目内容
【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积常数 | 1×10-14 | α | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则α____(填“<”“>”或“=”)1×10-14,作出此判断的理由是___________________。
(2)t1℃下,将pH=a的苛性钠溶液10mL与pH=b的稀硫酸500mL混合,测得溶液呈中性,若a+b=14,则此温度下水的离子积常数α=________。
(3)t2 ℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=10,则V1∶V2=________。
【答案】 > 水的电离是吸热过程,温度升高,水的电离程度增大,离子积增大 5×10-13 11:9
【解析】试题分析:本题考查水的电离和水的离子积的影响因素,溶液pH的计算。
(1)若25<t1<t2,水的电离是吸热过程,温度升高,水的电离程度增大,水的离子积增大,则α![]() 1
1![]() 10-14。
10-14。
(2)t1℃下,将pH=a的苛性钠溶液10mL与pH=b的稀硫酸500mL混合,测得溶液呈中性,则NaOH溶液中OH-物质的量与稀硫酸中H+物质的量相等, ![]() 10=10-b
10=10-b![]() 500,KW=50
500,KW=50![]() 10-(a+b),若a+b=14,此温度下水的离子积常数KW=50
10-(a+b),若a+b=14,此温度下水的离子积常数KW=50![]() 10-14=5
10-14=5![]() 10-13。
10-13。
(3)t2 ℃下,pH=11的苛性钠溶液中c(OH-)=0.1mol/L,pH=1的稀硫酸中c(H+)=0.1mol/L,两者混合所得混合溶液的pH=10,混合溶液中c(OH-)=0.01mol/L,即混合后碱过量,0.01mol/L=![]() ,则V1∶V2=11:9。
,则V1∶V2=11:9。

【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2 . 某同学在实验室中对NH3与NOx反应进行了探究:收集足量NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好).在一定温度下按图示装置进行实验. 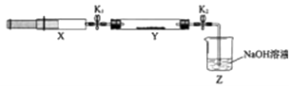
操作步骤 | 实验现象 | 解释原因 |
打开K1 , 推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中 | ②反应的化学方程式 |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③ | ④ |